
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比,由表格中数据可知,温度越高,K越小,则反应为放热反应,升高温度平衡逆向移动;
(2)830℃时,反应初始6s内A的平均反应速率v(A)=0.003mol/(L•s),可知转化的A为0.003mol/(L•s)×6s×5L=0.09mol,则
A(g)+B(g)?C(g)+D(g)
开始 0.2 0.8 0 0
转化 0.09 0.09 0.09 0.09
6s 0.11 0.71 0.09 0.09
(3)结合平衡的特征“等、定”判定平衡状态;
(4)互为逆反应时,K互为倒数关系.
解答 解:(1)A(g)+B(g)?C(g)+D(g) 的K=$\frac{c(C)c(D)}{c(A)c(B)}$,由表格中数据可知,温度越高,K越小,则反应为放热反应,升高温度平衡逆向移动,则升高温度,A的转化率减小,故答案为:$\frac{c(C)c(D)}{c(A)c(B)}$;放热;减小;
(2)830℃时,反应初始6s内A的平均反应速率v(A)=0.003mol/(L•s),可知转化的A为0.003mol/(L•s)×6s×5L=0.09mol,则
A(g)+B(g)?C(g)+D(g)
开始 0.2 0.8 0 0
转化 0.09 0.09 0.09 0.09
6s 0.11 0.71 0.09 0.09
则6s时c(A)=$\frac{0.11mol}{5L}$=0.022mol/L,C的物质的量为0.09mol,
故答案为:0.022;0.09;
(3)a.c(A)=c(C),不能确定正逆反应速率的关系,不能判定平衡,故不选;
b.该反应为气体体积不变的反应,容器中压强不变,不能判定平衡,故不选;
c.混合气体的m、n始终不变,则混合气体的平均相对分子质量不变,不能判定平衡,故不选;
d.v逆(D)=v正(B),为平衡状态,故选;
故答案为:d;
(4)互为逆反应时,K互为倒数关系,则1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为$\frac{1}{0.4}$=2.5,故答案为:2.5.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、K的表达式及计算、平衡三段法、平衡判定为解答的关键,侧重分析与应用能力的考查,注意K与温度的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | △H1<0△H3>0 | B. | △H5<0△H4<△H3 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:l | B. | 2:2:1 | C. | 1:1:2 | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易升华是因为分子间的共价键较弱 | |
| B. | 构成单质分子的微粒一定含有化学键 | |
| C. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
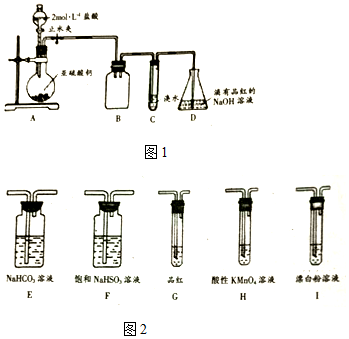
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请按要求回答下列有关氮的化合物参与相关反应的问题:
请按要求回答下列有关氮的化合物参与相关反应的问题:| n(NO)/mol | n(CO)/mol | n(N2)/mol | n(CO2)/mol | |
| 起始 | 1.2 | 1.0 | 0 | 0 |
| 2min末 | 0.4 | |||
| 4min末 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
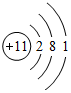 ,B离子的电子式
,B离子的电子式 ,C原子的名称氢原子,D原子的电子式
,C原子的名称氢原子,D原子的电子式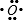 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D | E | F | G | H |
| 原子半 径(nm) | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要 化合价 | +2 | +3 | +2 | +6,-2 | -2 | +1 | +1 | +7,-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com