
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | 原Fe(NO3)2样品已变质 |
B | 向蛋白质溶液中分别加入甲醛和(NH4)2SO4饱和溶液,均有固体析出 | 蛋白质均发生了变性 |
C | 向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,产生白色沉淀和气体 | 白色沉淀和气体分别为CaCO3和CO2 |
D | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
A.AB.BC.CD.D
【答案】C
【解析】
A.向Fe(NO3)2溶液中滴加稀硫酸,酸性条件下硝酸根离子与亚铁离子发生氧化还原反应生成铁离子,结论不合理,故A错误;
B. 浓的无机盐溶液能使蛋白质发生盐析产生沉淀,向蛋白质溶液中加入 (NH4)2SO4饱和溶液,有固体析出是蛋白质发生盐析,不是变性,故B错误;
C. NaHCO3溶液中存在电离平衡HCO3-![]() CO32-+H+,向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,钙离子与碳酸根反应生成碳酸钙沉淀,使电离平衡向右移动,电离出的氢离子与过量的碳酸氢根离子反应生成二氧化碳和水,则白色沉淀和气体分别为CaCO3和CO2,故C正确;
CO32-+H+,向2 mL 0.5 mol·L-1 NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液,钙离子与碳酸根反应生成碳酸钙沉淀,使电离平衡向右移动,电离出的氢离子与过量的碳酸氢根离子反应生成二氧化碳和水,则白色沉淀和气体分别为CaCO3和CO2,故C正确;
D. 向溶有SO2的BaCl2溶液中通入氨气,氯化钡、二氧化硫和氨气反应生成亚硫酸钡白色沉淀,氨气表现碱性,不表现氧化性,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)。不能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g)。不能表示上述反应达到化学平衡状态的是( )
A.单位时间消耗2molN2,同时生成6molH2
B.c(HCl)保持不变
C.混合气体密度保持不变
D.c(N2):c(H2):c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与人类生产、生活息息相关。
(1)FeCl3可用作止血剂。基态铁原子的核外电子排布式为______, Fe3+有______个未成对电子。
(2)K3[Fe(CN)6]主要应用于照相纸、颜料、制革、印刷等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
①K3[Fe(CN)6]中所涉及的元素的第一电离能由大到小的顺序_________。
②(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_________。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为________。
(3)CO能与金属Fe所形成的配合物Fe(CO)5,其熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示:

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_________。
A Fe(CO)5是非极性分子,CO是极性分子
B Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C 1mol Fe(CO)5含有10mol配位键
D 反应Fe(CO)5 = Fe+5CO没有新化学键生成
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示:
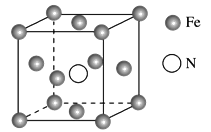
则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证AgI和 AgCl的 Ksp大小 | 向1mL 1mol·L-1NaCl溶液中滴加2滴 2mol·L-1 AgNO3溶液,生成白色沉淀;再滴加 2滴1mol·L-1KI溶液,白色沉淀变成黄色沉淀 | AgCl(s)+I-(aq) |
B | 比较HClO和 HF溶液的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO 溶液、0.1mol·L-1NaF 溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升髙显著增大 |
D | 检验某溶液中是否含有CO32- | 先滴加盐酸产生气泡,将该气体通入澄清石灰水中,有白色沉淀生成 | 该溶液中一定含有CO32- |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电池在运行时可同时实现净化有机物污水、净化含Cr2O72-废水(pH约为6)和淡化食盐水,其装置示意图如下图所示。图中,D和E为阳离子交换膜或阴离子交换膜,Z为待淡化食盐水。已知Cr3+完全沉淀所需的pH为5.6。下列说法不正确的是
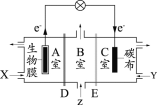
A.E为阴离子交换膜
B.X为有机物污水,Y为含Cr2O72-废水
C.理论上处理1mol的Cr2O72-的同时可脱除6mol的NaCl
D.C室的电极反应式为Cr2O72- + 6e- + 8H+=2Cr(OH)3↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge在周期表中的位置__________,基态Ge原子的核外电子排布式为[Ar] _______,有 __________个未成对电子。
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Ge、O两元素电负性由大至小的顺序是 _________。
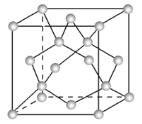
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 ________,微粒之间存在的作用力是___________。
(4)晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm(1pm=10-12m),其密度为_______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置能达到实验目的的是
A |
| 淸洗铜与浓硫 酸反应后有残 液的试管 | B |
| 配置一定物质的量浓度的溶液实验中,为定容时的操作 |
C |
| 以淀粉为指示 剂,用酸式滴 定管盛放 Na2S2O3标准溶液进行滴定 | D |
| 装置为制备并用 排气法收集NO 气体的装置(稀硝酸+钢屑) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]一定增大
B. 向0.1 mol·L-1的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
C. 向0.1 mol·L-1的NaHSO3溶液中加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+c(SO32-)
D. 可用浓度大于0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃[已知Ksp(BaSO4)=1.1×10-10]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com