
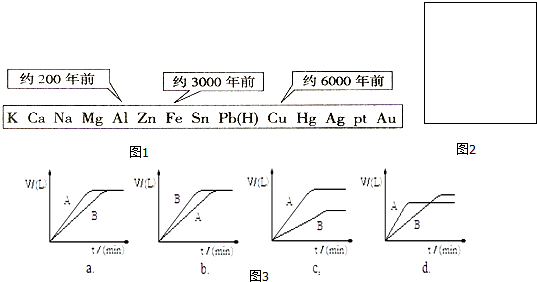
���� ��1����ͼ�����жϳ���������뿪�����õ��Ⱥ��ϵ��Խ�����õķ���Խ�磻
��2��ԭ��ص��ܷ�ӦΪFe+Cu2+=Fe2++Cu������ԭ��ط�Ӧ���ԭ��أ�ԭ�����������Ϊ�ϲ����ý�����ǽ������ϣ������Ϸ�����ԭ��Ӧ��
��3���� A��B ���Թ��зֱ����������ͬ�����ۣ��ֱ�������ͬŨ�ȵ�ϡH2SO4�У�ͬʱ��A�з���������CuSO4��Һ��������Fe+Cu2+=Fe2++Cu���γ�ԭ��أ���Ӧ�����������ɵ������٣�
��4��ͭ��Ũ������Ҫ���ȷ�����Ӧ����ϡ�����Ӧ��ͭ��ϡ������Һ��Ӧ�����Ʊ�����ͭӦѡ��ͭ��ϡ����ϡ�����Ϸ�Ӧ��
��� �⣺��1����ͼʾ���Կ��������Ļ�Դ�С������Ŀ������õ��Ⱥ��йأ��ʴ�Ϊ��d��
��2��ԭ��ص��ܷ�ӦΪFe+Cu2+=Fe2++Cu�����ԭ����У�FeΪ������������ӦFe-2e-=Fe2+��Cu����C��Ϊ����������������ԭ��Ӧ���缫��ӦʽΪCu2++2e-=Cu���������ҺΪ����ͭ��Һ����ԭ���װ��Ϊ ��
��
�ʴ�Ϊ�� ��
��
��3���� A��B ���Թ��зֱ����������ͬ�����ۣ��ֱ�������ͬŨ�ȵ�ϡH2SO4�У�ͬʱ��A�з���������CuSO4��Һ�������ķ�ӦΪFe+Cu2+=Fe2++Cu��ͭ-��-ϡ�����γ�ԭ��أ���Ӧ��������Ӧ����ʱ������B�������ɵ�������Ҳ����B��ͼ��ӦΪd��
�ʴ�Ϊ��d��
��4��ͭ��Ũ������Ҫ���ȷ�����Ӧ����ϡ�����Ӧ��ͭ��ϡ������Һ��Ӧ������ 1mol Cu�����ʾ�Ϊ 1mol ��Ũ���ᡢϡ�����ϡ���ᣬ����ȡ���������ͭ�������Լ�ͭ��ϡ���ᡢϡ���ᣬ�μӷ�Ӧ��ϡ����ȫ������������3Cu+8H++2NO3-=3Cu2++2NO��+4H2O�������Ҫ�����֪1molͭ��Ӧ��Ҫ������2.7mol����Ҫ���������$\frac{2}{3}$mol������1mol����ȫ����Ӧ��ȡ$\frac{2}{3}$molHNO3����ʹͭ������ȫ����Ӧ����Ӧ�Ļ�ѧ����ʽΪ��3Cu+3H2SO4+2HNO3=3CuSO4+2NO��+4H2O��
�ʴ�Ϊ��ͭ��ϡ���ᡢϡ���3Cu+3H2SO4+2HNO3=3CuSO4+2NO��+4H2O��
���� ���⿼�������ұ�������ӷ���ʽ��д��ԭ�����ƺ͵缫��Ӧʽ��д��������ԭ��Ӧ���������жϣ���Ŀ�ѶȲ���ע�⣨4���з�Ӧ������ϵ�ǽ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͬ�¶�ʱ��100mL0.01mol/L�Ĵ�����Һ��10mL0.1mol/L�Ĵ�����Һ��Ƚϣ�H+�����ʵ���ǰ�ߵ��ں��� | |
| B�� | ��ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3KJ/mol��������1mol CH3COOH��ϡ��Һ�뺬1molNaOH��ϡ��Һ��ϣ��ų�������С��57.3KJ | |
| C�� | ��Ӧ2Mg��s��+CO2��g���TC��s��+2MgO��s�����Է����У���÷�Ӧ�ġ�H��0 | |
| D�� | N2��g��+3H2��g���T2NH3��g����H��0��������������ʱ�����¶ȣ���Ӧ���ʺ�������ƽ��ת���ʾ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȷ� | B�� | �� | C�� | �ƾ� | D�� | KI ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ����ϩ��C6H5CH=CH2�� | ||
| C�� | ��ϩ��CH3CH=CH2�� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�Ρ���ˮ | B�� | �ȡ��塢�� | C�� | �ơ�þ���� | D�� | �ռ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �Ա������ڿ��������ȶ����� | |
| B�� | 1 mol���м���������11 mol H2��Ӧ | |
| C�� | 2��5-���ǻ�����ͪ�ܷ����ӳɡ�ȡ�������۷�Ӧ | |
| D�� | ������������������4 molNaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H2O2+Cl2�T2HCl+O2��Ӧ�У�ÿ����32g��������ת��4NA������ | |
| B�� | 17.4gij���ף���ͼ�� �к�P-S����ĿΪ0.6NA �к�P-S����ĿΪ0.6NA | |
| C�� | ÿ�������к�8��̼ԭ�ӵ�ij����1mol���к�̼̼�����ĸ������Ϊ7NA | |
| D�� | ��״���£�22.4LSO2��O2�Ļ�����壬����2NA����ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com