
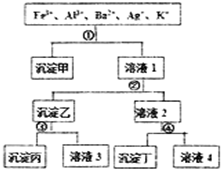
 某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )| A. | 沉淀乙是氢氧化铝和氢氧化银的混合物 | |
| B. | 溶液3中含有Al3+ | |
| C. | 试剂①是NaCl,试剂④是H2SO4 | |
| D. | 溶液4含有三种阳离子,分别是H+、Na+、K+ |
分析 Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,Ag+可与H2SO4、NaOH、NH3•H2O、NaCl四种溶液反应生成沉淀,
Fe3+、Al3+可与NaOH、NH3•H2O反应生成沉淀,而Ba2+只与H2SO4反应生成沉淀,加入①时,只产生一种沉淀,故①一定是NaCl,沉淀甲为AgCl;在滤液1中加入②后,生成两种沉淀,故②是NH3•H2O或NaOH而生成的沉淀,有一种在③中溶解,故②为NH3•H2O,③为NaOH,沉淀乙为氢氧化铁和氢氧化镁,沉淀丙为氢氧化镁,溶液3为偏铝酸钠,④为H2SO4,沉淀丁为硫酸钡,溶液4为氯化钠等,以此解答该题.
解答 解:从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀.第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3•H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离.第④步用SO42-将Ba2+和K+分离,
A.沉淀乙是Fe(OH)3和Al(OH)3的混合物,故A错误;
B.溶液3中含有AlO2-,故B错误;
C.由以上分析可知试剂①是NaCl,试剂④是H2SO4,故C正确;
D.因分别加入氨水、氯化钠、硫酸,溶液4含有四种阳离子,分别是H+、Na+、K+、NH4+,故D错误.
故选C.
点评 本题考查物质的推断,侧重与金属阳离子的定性分析,涉及物质的分离和提纯实验方案的设计,题目难度不大,注意根据物质的性质进行实验设计.


科目:高中化学 来源: 题型:选择题
| A. | 将少量SO2通入氨水和硝酸钡的混合溶液中产生白色沉淀,说明NO3-将SO2氧化生成了硫酸钡 | |
| B. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| C. | 为除去乙酸乙酯中混有的少量乙酸杂质,可向混合溶液中加入适量的乙醇并加热 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
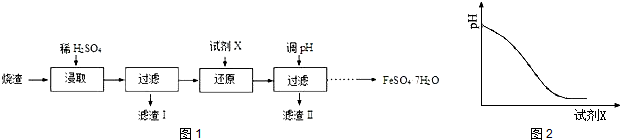
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
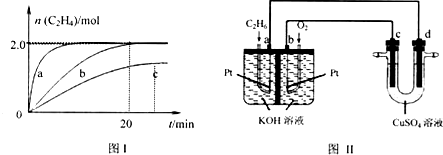
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
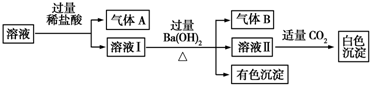
| A. | A是CO2,B是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+ | |
| D. | 溶液中一定不存在Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 既是氧化剂,又是还原剂 | |
| B. | Fe2O3在反应中得到电子 | |
| C. | 3 mol Na2O2参加反应,转移的电子总数为12mol | |
| D. | Na2FeO4能消毒杀菌,因其具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
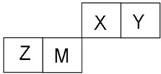 X、Y、Z、W四种短周期元素在周期表中的位置如右图,其中只有Z为金属元素.回答下列问题:
X、Y、Z、W四种短周期元素在周期表中的位置如右图,其中只有Z为金属元素.回答下列问题: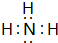 ,该气态氢化物可以用浓盐酸来检验,其反应产物的化学式为NH4Cl,所得产物中包含的化学键为离子键、共价键.
,该气态氢化物可以用浓盐酸来检验,其反应产物的化学式为NH4Cl,所得产物中包含的化学键为离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com