
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变 成血红色 | Fe2+既有氧化性 又有还原性 |
B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
C | 室温下,向浓度均为0.1mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
A. A B. B C. C D. D
科目:高中化学 来源:2016-2017学年辽宁省北校高一3月月考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z和W 的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6∶7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A. X单质不可以与CO2反应
B. Y的氧化物是良好的半导体材料
C. Z的氢化物比W的氢化物更稳定
D. X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:简答题
氨气在生产、生活和科研中应用十分广泛。
(1)以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+72kJ·mol-1
H2O(l)=H2O(g) △H=+44kJ·mol-1
则反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=______kJ·mol-1
(2)某温度下,向容积为100 ml的密闭容器中通入4molNH3和2molCO2发生反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。
CO(NH2)2(s)+H2O(g),物质X的浓度变化曲线如下图所示。
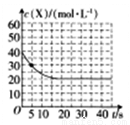
①前5s内,v(H2O)=__________。
②该条件下的平衡常数K=_______。
(3)T℃时,将等物质的量的NO和CO充入体积为2L的密闭容器中,保持温度和体积不变,反应过程(0——15min)中NO的物质的量随时间的变化如图所示。
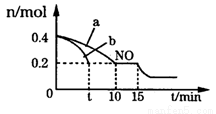
①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将____(填“向左”“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____。
(4)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入如图所示的电解池(电极为惰性材料)中进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。
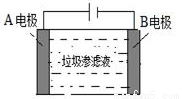
①写出第二步反应的化学方程式_________。
②若垃圾渗滤液中氨氮物质的含量为1.7%,则理论上电解1t该污水,电路中转移的电子数为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省淮北市高二下学期第一次月考化学试卷(解析版) 题型:选择题
已知25℃时某溶液中含有大量Na+、H+、Fe3+、HC03-、OH-、I-中的几种,并且水 电离出的c(H+)=1×lO-13 mol/L.当向该溶液中缓慢通入一定量的Cl2后,溶液由无色 变为黄色.下列有关分析正确的是
A. 溶液的pH=1或13 B. 溶液中一定没有Fe3+,Na+
C. 溶液中阴离子有I-,不能确定HCO3- D. 当Cl2过量,所得溶液只含有两种盐
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:推断题
有机物A有如下转化关系:
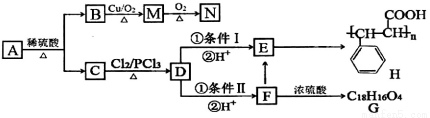
已知:①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%。
②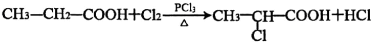
根据以上信息,回答下列问题:
(1)B的分子式为__________;有机物D中含氧官能团名称是__________。
(2)A的结构简式为__________;检验M中官能团的试剂是__________。
(3)条件I为__________;D→F的反应类型为__________。
(4)写出下列转化的化学方程式:
F→E___________________________,
F→G___________________________。
(5)N的同系物X比N相对分子质量大14,符合下列条件的X的同分异构体有__________种(不考虑立体异构)
①含有苯环 ②能发生银镜反应 ③遇FeCl3溶液显紫色
写出其中核磁共振氢谱有五组峰,且吸收峰的面积之比为1∶1∶2∶2∶2的同分异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古包头市高三下学期第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是( )
A. 2-甲基丁烷也称异丁烷 B. 乙烯、苯都能发生加成反应
C. 乙烯、聚氯乙烯分子中都含有碳碳双键 D. 淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一下学期第一次月考化学试卷(解析版) 题型:选择题
香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是
A. 原子半径:Y>Z>R>T
B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z
D. XR2、WR2两化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源:四川省广安、遂宁、内江、眉山四市2017届高三第二次诊断考试理综化学试卷 题型:填空题
铁、锌、镍、铬及其合金在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________,基态铁原子有_________种不同运动状态的电子。
(2)镍可与CO形成配合物Ni(CO)n,CO分子中σ键与π键的个数比为________;该配合物中原子Ni的价层电子总数为18,则n=________,该配合物的熔点是170℃,则Ni(CO)n 属于__________
(3)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______,乙醛分子中H—C=O的键角_______(填“大于”、“等于”或“小于”)乙醇分子中的H—C—O的键角。乙醇和乙醛均极易溶于水,其主要原因是_______________。
(4)立方NiO晶体结构类似于NaCl,则Ni2+填入O2-构成的________空隙(填“正四面体”、“正八面体”、“立方体”或“压扁八面体”)。其晶胞边长为ɑ pm,列式表示NiO晶体的密度为____g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源:2017届江苏省南通市高三高考全真模拟(五)化学 试卷(解析版) 题型:选择题
一定温度下向体积为2L的恒容密闭容器中充入6 molCO2和8mo1H2,发生反应:CO2 (g)+3 H2(g)= CH3OH(g)+H2O(g) △H=-49kJ·mol-1。测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
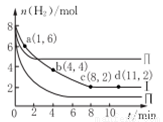
A. 该反应在O~8min内的v(CO2)=0.125mol·L-1·min-1
B. 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20%
C. 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆)
D. 曲线II、曲线III改变条件分别是升高温度、减小压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com