
| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中化学键类型完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | M的气态氢化物比N的气态氢化物稳定 |
分析 X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,最外层电子数为6,则X是O元素;X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;Y原子在短周期主族元素中原子半径最大,则Y是Na元素.
解答 解:X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,最外层电子数为6,则X是O元素;X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;Y原子在短周期主族元素中原子半径最大,则Y是Na元素.
A.M是S元素、X是O元素,二者形成的化合物对应的水化物中,H2SO3是弱酸,H2SO4是强酸,故A错误;
B.Na2O中只含离子键、Na2O2中含有共价键和离子键,所以化学键类型不相同,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径:r(O2-)>r(Na+),故C正确;
D.元素非金属性越强,其气态氢化物的稳定性越强,非金属性N(Cl)>M(S),所以气态氢化物的热稳定性:M<N,故D错误;
故选C.
点评 本题考查原子结构和元素周期律的关系,明确元素种类是解题关键,注意对元素化合物的掌握,题目难度不大,知道过氧化钠中存在的化学键.


科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 21 | C. | 20 | D. | 19 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH2与HCl加成 | B. | CH3CH2CH2Cl在碱性溶液中水解 | ||
| C. | CH3CH2OH与浓H2SO4混合加热 | D. | CH3CHBrCH2CH3与NaOH醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH中含有离子键也含有共价键,属于离子化合物 | |
| B. | HCl中存在离子键,属于离子化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 阴、阳离子间通过静电引力而形成的化学键叫做离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
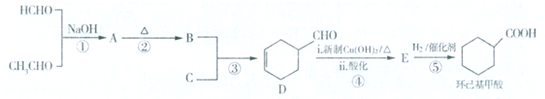
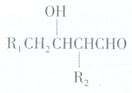 或
或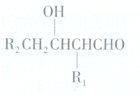
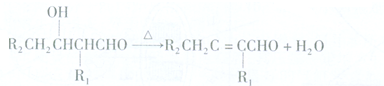
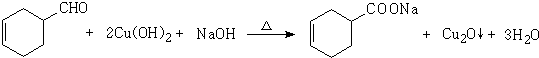 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com