
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:2X(g)+Y(g) Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
A.60 s内X的平均反应速率为0.01 mol·L-1·s-1
B.升高温度,若X的体积分数减小,则正反应的△H<0
C.将容器的容积变为20 L,达平衡后Z的浓度为0.015 mol·L-1
D.保持温度和体积不变,若再充入1 mol X,Y的转化率将增大
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH  B.相对分子质量:Ar>K
B.相对分子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
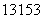 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中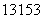 I的含量变化来监测核电站是否
I的含量变化来监测核电站是否
发生放射性物质泄漏。下列有关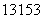 I的叙述中错误的是 ( )
I的叙述中错误的是 ( )
A. 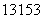 I的化学性质与
I的化学性质与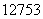 I相同
I相同
B. 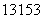 I的原子序数为53
I的原子序数为53
C. 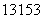 I的原子核外电子数为78
I的原子核外电子数为78
D. 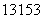 I的原子核内中子数多于质子数
I的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学反应速率的认识正确的是
A.H+和OH—的反应活化能接近于零,反应几乎在瞬间完成
B.对于任何化学反应来说,反应速率越大,反应现象就越明显
C.选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大
D.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实均能说明醋酸是弱电解质的是
①醋酸与水能以任意比互溶 ②醋酸溶液能导电 ③醋酸溶液中存在醋酸分子 ④0.1 mol/L醋酸溶液的pH比0.1 mol/L盐酸的pH大 ⑤醋酸能和碳酸钙反应放出CO2 ⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢
A.②③⑥ B.④⑤⑥ C.③④⑥ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,将一定量的冰醋酸(无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示。

请完成下列问题:
(1)上述a、b、c三点对应醋酸的电离程度最大的是 (填“a”、“b”、“c”),三点对应溶液中c(OH-)由大到小的顺序为 。
(2)c点对应的溶液中c(H+)与c(CH3COO-)+c(OH-)的关系为前者 (填“大于”“小于”“等于”)后者。
(3)从a点到b点,溶液中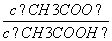 的比值 (填“增大”、“减小”、“等于”)。
的比值 (填“增大”、“减小”、“等于”)。
(4)25 ℃时,体积均为100 mL 、pH=m的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。则稀释前两溶液中c(OH-)= , HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。

(5)若用pH试纸进行实验,你能否区分上述HX和CH3COOH两种酸溶液?若能,请简述操作过程;若不能,请说明理由。 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碱金属的电子结构和性质的叙述中不正确的是( )
A.碱金属原子最外层都只有一个电子,在化学反应中容易失去
B.都是强还原剂
C.都能在O2中燃烧生成过氧化物
D.都能与水反应生成碱
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A.元素A、B组成的化合物可能是NH3
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
C. C、D、E的半径:C>D>E
D.化合物AE与CE具有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置是某种气体X的制取装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。请回答下列问题:
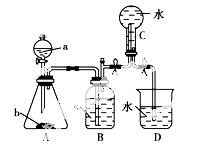
(1)气体X的化学式是________。
(2)所选药品a是________,b是________,装置B的作用是_______________________________。
(3)用所选的药品制取X的离子方程式是______________________________________。
(4)在反应刚开始时A中的主要现象是________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com