
科目:高中化学 来源:不详 题型:单选题
| A.1.5mol/L | B.2moi/L | C.lmol/L | D.无法确定 |
查看答案和解析>>
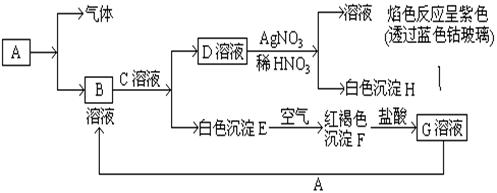
科目:高中化学 来源:不详 题型:填空题
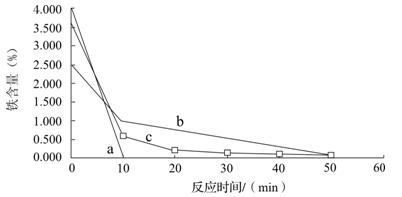
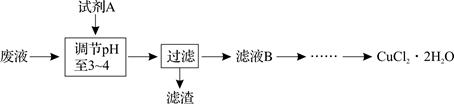
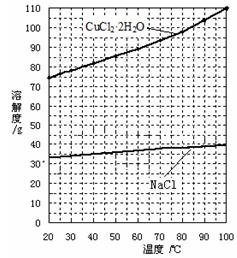
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该灰黑色粉末用做抗氧化剂 | B.小纸袋内可能装有活性铁粉 |
| C.小纸袋内的原装粉末可能是Fe2O3 | D.该灰黑色粉末不可食用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.冷凝管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
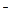 直接反应制得,请配平下列反应的离子方程式: Cu2+ + I
直接反应制得,请配平下列反应的离子方程式: Cu2+ + I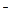 — CuI + I
— CuI + I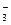
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.完全溶解89g针铁矿,需要1.5mol/L的稀盐酸至少2L |
| B.针铁矿的化学式是FeO(OH) |
| C.针铁矿中铁元素为+3价 |
| D.44.5g针铁矿约含有6.02×1023个O2。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Zn2+、Cu、Fe3+ | B.Zn、Cu2+、Fe3+ |
| C.Zn2+、Cu2+、Fe、Fe2+ | D.Zn2+、Cu、Cu2+、Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com