

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �����ѣ�CH3OCH3����һ����Ҫ�������Դ����ҵ���ƶ���������һ�����¶ȣ�230��290�棩�ʹ��������½��еģ���Ӧ�з���������һЩ��Ӧ��CO(g)+2H2(g)
�����ѣ�CH3OCH3����һ����Ҫ�������Դ����ҵ���ƶ���������һ�����¶ȣ�230��290�棩�ʹ��������½��еģ���Ӧ�з���������һЩ��Ӧ��CO(g)+2H2(g)
|
|
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ҵ�������ķ�ӦΪCO(g) + H2O(g) CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
��1������H2O(g)��Ũ�ȣ�CO��ת���ʽ� ���������С�����䡱����
��2��ƽ�ⳣ���ı���ʽK �� ��400 ��ʱ��ƽ�ⳣ��K 9���>����<����=������
��3��500 ��ʱ��10min��v(H2O)�� ���ڴ˹�������ϵ�������� ������ӡ����١��� kJ��
��4����֪ 2H2 (g) + O2 (g) = 2H2O(g) ��H����484kJ/mol
�����ͼд��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�����÷�Ӧ:CO(g)+H2O(g)![]() CO2(g)+H2(g)����H=Q kJ��mol-1,�Ʊ�H2 .��֪�÷�Ӧ��ƽ�ⳣ��K���¶ȵĹ�ϵ��ͼ��ʾ��
CO2(g)+H2(g)����H=Q kJ��mol-1,�Ʊ�H2 .��֪�÷�Ӧ��ƽ�ⳣ��K���¶ȵĹ�ϵ��ͼ��ʾ��
����һ�ݻ��̶����ܱ�������,��850��ʱ����������Ӧ,����������ڸ����ʵ�Ũ��(mol��L�D1)��ʱ��ı仯��ϵ���±�:
| t/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
��֪:850��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K=1.0,��ش���������:
(1)���п����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_______.
A.��λʱ���ڼ���CO(g)��Ũ�ȵ�������CO2(g)��Ũ��
B.��Ӧ�����ڵ�ѹǿ�������仯
C.���������H2(g)��Ũ�Ȳ��ٷ����ı�
D.�������������ʵ���ˮ����������
(2)Q______0(���������=������).
(3)����850��ʱ��Ӧ�����г���H2O(g),Kֵ_____(���������С�����䡱).
(4)��ƽ��ʱCO2�ķ�Ӧ����______,CO(g)��ת����Ϊ_______.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ�갲��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��6�֣���1����֪��Ȼ����ˮ������Ӧ���Ȼ�ѧ����ʽΪ��CH4(g) + H2O(g)  CO(g)+ 3H2(g) ��H ��+206.4kJ��mol-1�����Ƶ�56g CO��Ҫ���յ�����Ϊ kJ��
CO(g)+ 3H2(g) ��H ��+206.4kJ��mol-1�����Ƶ�56g CO��Ҫ���յ�����Ϊ kJ��
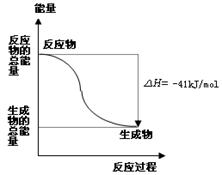
��2��CO�ɼ�����ˮ������Ӧ��CO(g)+H2O(g) CO2(g)+H2(g) ��H ����41.0kJ��mol��1 ������1mol CH4������ˮ������ַ�Ӧ�õ�1molCO2���÷�Ӧ���ʱ䦤H �� kJ��mol��1��
CO2(g)+H2(g) ��H ����41.0kJ��mol��1 ������1mol CH4������ˮ������ַ�Ӧ�õ�1molCO2���÷�Ӧ���ʱ䦤H �� kJ��mol��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ����������һ�и߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ���ѡ��
700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������CO��H2O,������Ӧ��
CO(g)��H2O(g)  CO2��H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t1��t2����
CO2��H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t1��t2����
| ��Ӧʱ��/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com