
【题目】CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
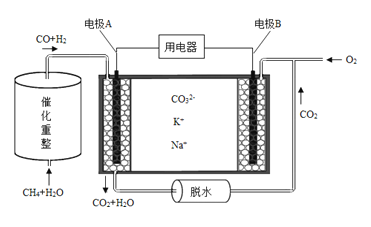
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
【答案】(1)3NA(2)c+3b-2a;
(3)①![]() mol·L-1·min·-1;②6.75;③吸热;
mol·L-1·min·-1;②6.75;③吸热;
(4)①B;②CO+3H2+4CO32――8e-=5CO2+3H2O;
【解析】试题分析:(1)在反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)中,甲烷中碳元素的化合价由-4价升高到+2价,1mol甲烷转移6mol电子,8g甲烷的物质的量为8g÷16g/mol=0.5mol,则转移的电子数为0.5mol×6×NA=3NA。
CO(g)+3H2(g)中,甲烷中碳元素的化合价由-4价升高到+2价,1mol甲烷转移6mol电子,8g甲烷的物质的量为8g÷16g/mol=0.5mol,则转移的电子数为0.5mol×6×NA=3NA。
(2)①2CO(g)+O2(g)=2CO2(g)△H1=akJ·mol-1,
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1,
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3="c" kJ·mol-1,
根据盖斯定律,③+3×②-2×①得CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4= c+3b-2akJ/mol。
CO(g)+3H2(g) △H4= c+3b-2akJ/mol。
(3)①根据题意,甲烷的最初浓度为1mol/L,经过tmin,反应达到平衡,平衡时c(CH4)=0.5mol·L-1,则反应消耗甲烷0.5mol,根据反应掉的浓度和化学计量数成正比,则反应消耗氢气为1.5mol/L,v(H2)=1.5/tmol·L-1·min·-1;②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5molL-1,氢气的浓度为1.5mol/L,CO的浓度为0.5mol/L,水蒸气的浓度为0.5mol/L,则该温度K=[c(CO)c3(H2)]÷[c(CH4)c(H2O)]= [0.5×1.53]÷[0.5×0.5]=6.75;③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,CO的浓度增大,说明平衡正反应方向移动,而升高温度,平衡向吸热反应方向移动,则该反应是吸热反应。
(4)①根据图示,CO和氢气在电极A放电发生氧化反应生成CO2和水,则电极A为负极,,电极B为正极,所以放电过程中K+和Na+向电极B移动;②该电池的负极为CO和氢气在电极放电发生氧化反应生成CO2和水,则电极反应式为CO+3H2+4CO32――8e-=5CO2+3H2O。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.NaCl B.H2SO4 C.CuCl2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关颜色的变化不能用勒夏特列原理解释的是( )
A.平衡状态的H2、I2、HI混合气体体积压缩时颜色变深
B.平衡状态的NO2和N2O4混合气体体积压缩时颜色先变深后变浅
C.平衡状态的NO2、CO、NO、CO2混合气体升温时颜色变深
D.向Fe(SCN)3溶液中滴加几滴浓KSCN溶液后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质及非电解质的组合完全正确的是( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | NaOH | HNO3 |
弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
非电解质 | Cl2 | CO2 | C2H5OH | SO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在番茄幼苗的培养液中,除了必需的微量元素、NH4+、PO43-和CO2外,还必需的大量元素有()
A. C.H、O、N
B. K、CA.Mg、Fe
C. Mn、Mo、Cu、Zn
D. K、CA.Mg、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( )
A. 0.1(b-2a)mol·L-1 B. 10(2a-b) mol·L-1
C. 10(b-2a) mol·L-1 D. 10(b-a) mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com