
【题目】温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A. ③①④②⑤
B. ①③⑤④②
C. ③②①⑤④
D. ⑤②④①③
科目:高中化学 来源: 题型:
【题目】关于离子键、共价键的各种叙述中,下列说法中正确的是
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如 Cl2)中
C.原子序数为 11 与 9 的元素能够形成离子化合物,该化合物中存在离子键
D.任何物质中都存在化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3mol Cu时,另一个电极上生成的气体在标准状况下的体积是( )
A.5.6L
B.6.72L
C.1.344L
D.11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SO2的叙述正确的是( )
A.SO2是无色无味有毒的气体B.SO2有毒,不能做食品添加剂
C.SO2不溶于水D.SO2与NaOH反应能生成Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓硫酸的性质,下列说法错误的是( )
A.浓硫酸的吸水性是化学变化B.浓硫酸有酸性和强氧化性
C.浓硫酸有吸水性和脱水性D.浓硫酸能做干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①25℃时弱电解质电离平衡数;Ka(CH3COOH)═1.8×10﹣5 , Ka(HSCN)═0.13;
难溶电解质的溶度积常数:KSD(CaF2)═1.5×10﹣10
②25℃时,2×l0﹣3molL﹣1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c (HF)、C(F﹣)与溶液pH的变化关系,如图1所示: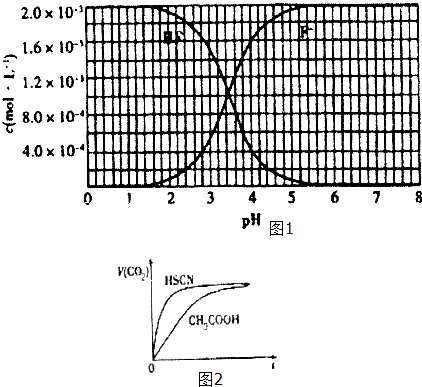
请根据以下信息回答下列问题:
(1)25℃时,将20mL 0.10molL﹣1CH3COOH溶液和20mL 0.l molL﹣1 HSCN溶液分别 与20mL 0.10molL﹣1NaHCO3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示: 反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,
反应结束后所得两溶液中,C(CH3COO﹣)c(SCN﹣)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈ .
(3)4×10﹣3molL﹣1HF溶液与4×10﹣4molL﹣1CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2与NH4Cl溶液共热制N2:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。
NaCl+N2↑+2H2O。
②工业制氮化铝:Al2O3+3C+N2![]() 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O![]() NaAlO2+NH3↑。
NaAlO2+NH3↑。
Ⅰ.氮化铝的制备
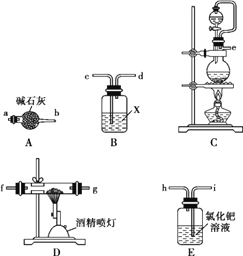
(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→____________(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是____;E装置内氯化钯溶液的作用可能是_______。
Ⅱ.氮化铝纯度的测定
【方案ⅰ】甲同学用下图装置测定AlN的纯度(部分夹持装置已略去)。
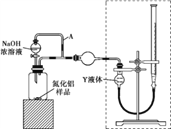
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是____。
a.CCl4 b.H2O c.NH4Cl饱和溶液 d.植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是____ (填“偏大”“偏小”或“不变”)。
【方案ⅱ】乙同学按以下步骤测定样品中AlN的纯度。
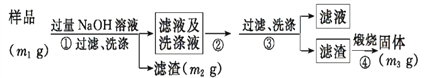
(5)步骤②的操作是_________。
(6)实验室里煅烧滤渣使其分解,除了必要的热源和三脚架以外,还需要的仪器有______等。
(7) 样品中AlN的纯度是__________(用m1、m2、m3表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
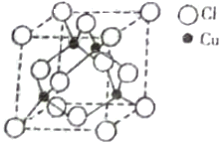
【题目】铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。
(1)请写出铜的基态原子核外电子排布式:___________。
(2)铜的熔点比钙的高,其原因是____________。
(3)金属铜的堆积方式为下图中的______(填字母序号)。

(4)科学家通过 X 射线推测,胆矾的结构如下图所示。

胆矾的阳离子中心原子的配位数为______,阴离子的空间构型为_______。胆矾中所含元素的电负性从大到小的顺序为_________(用元素符号作答)。
(5)铜与Cl原子构成晶体的晶胞结构如右图所示,该晶体的化学式为______,已知该晶体的密度为 4.14g/cm3,则该晶胞的边长为_______pm(写计算式)。将该物质气化后实验测定其蒸汽的相对分子质量为 198,则其气体的分子式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com