
| A. | 丙烯 | B. | 1-丁烯 | C. | 2-甲基-2-戊烯 | D. | 2-己烯 |
分析 具有顺反异构体的有机物中C=C应连接不同的原子或原子团,以此解答该题.
解答 解:A.丙烯为CH3CH=CH2,其中C=C连接相同的H原子,不具有顺反异构,故A错误;
B.1-丁烯为CH3CH2CH=CH2,其中C=C连接相同的H原子,不具有顺反异构,故B错误;
C.2-甲基-2-戊烯CH3C(CH3)=CHCH2CH3,其中C=C连接相同的H原子,不具有顺反异构,故C错误;
D.2-己烯为CH3CH=CHCH2CH2CH3,其中C=C连接不同的H、-CH3、-CH2CH2CH3,具有顺反异构,故D正确.
故选D.
点评 本题考查有机物的同分异构体,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意把握顺反异构的结构要求.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同条件下体积一定相同 | B. | 氧原子个数一定相同 | ||
| C. | 分子个数一定相同 | D. | 质量比是22:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4是N2的同素异形体 | |
| C. | N4分子中N-N键角为109°28′ | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出248 kJ的热量 | B. | 吸收248 kJ的热量 | ||
| C. | 放出183 kJ的热量 | D. | 吸收183 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:填空题
【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4===2 KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=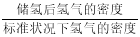 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com