
分析 (1)FeCl3溶液中滴加KSCN溶液,溶液变红,证明Fe3+存在;
(2)铁设备中的Fe会与铁离子反应生成亚铁离子;FeCl3溶液也和金属铜反应生成氯化铜和氯化亚铁;
(3)控制条件使平衡正向移动,水解为吸热反应,所以降温平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;
(4)氯酸钠氧化酸性的氯化亚铁,得到氯化铁溶液,据此回答;
(5)酸性废水中的H+会导致氯化铁不能形成胶体或者胶体非常少,据此回答.
解答 解:(1)FeCl3溶液中滴加KSCN溶液,溶液变红,证明Fe3+存在,故答案为:取少量FeCl3溶液,滴加KSCN溶液,溶液变红,证明Fe3+存在;
(2)钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,FeCl3溶液也和金属铜反应生成氯化铜和氯化亚铁2Fe3++Cu=2Fe2++Cu2+
,故答案为:2Fe3++Fe=3Fe2+;2Fe3++Cu=2Fe2++Cu2+;
(3)控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以降温,平衡逆向移动;加水稀释,则水解平衡也正向移动;加入氯化铵,氯化铵溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故选bd;
故答案为:bd;
(4)氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,
故答案为:6Fe2++6H++ClO3-═6Fe3++Cl-+3H2O;
(5)酸性废水中的H+会导致氯化铁不能形成胶体或者胶体非常少,因此不能吸附悬浮物沉降而除去,
故答案为:酸性废水中的H+会导致氯化铁不能形成胶体或者胶体非常少,因此不能吸附悬浮物沉降而除去.
点评 本题考查铁的化合物性质的应用、氧化还原反应方程式的配平、平衡移动影响因素等,需要学生具备扎实的基础与灵活运用难度,难度中等.


科目:高中化学 来源: 题型:解答题

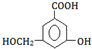
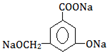 .
.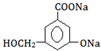 .
.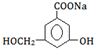 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应至6min时,c(H2O2)=0.3mol/L | |
| D. | 反应至6min时,H2O2分解了50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| |温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,玻璃棒的作用是引流 | |
| C. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的液面以下 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能加快反应速率 | |
| B. | 压强增大不影响化学反应速率 | |
| C. | 冬天气温低,反应速率降低,对人类危害减小 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?XY2 | B. | 3X2+Y2?2X3Y | C. | 2X2+Y2?2X2Y | D. | X2+3Y2?2XY3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com