
| A. | Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 | |
| B. | 若在恒容容器中发生反应:N2+3H2?2NH3,达到平衡后再充入适量He,由于压强增大,化学平衡向正反应方向移动 | |
| C. | 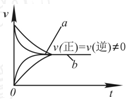 在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率-时间图象可用图表示 | |
| D. | 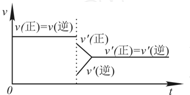 若在恒压容器中发生反应:2SO3?2SO2+O2,达到平衡后再充入适量He,其速率-时间图象可用图表示 |
分析 A、加热提高了分子的活化能,反应速率加快;
B、反应N2+3H2?2NH3是气体体积减小的反应,恒容容器中加入惰气总压增大,气体分压不变,物质浓度不变平衡不移动;
C、加入催化剂,降低反应的活化能,反应速率增大,但化学平衡不变;
D、反应是一个气体体积增大的反应,在恒压容器加入He,体积增大使压强减小,反应速率减小,平衡向气体体积增大的方向进行.
解答 解:A、反应的反应热对于确定反应是不变的,加热提高了分子的活化能,反应速率加快,和反应热的大小无关,故A错误;
B、反应N2+3H2?2NH3是气体体积减小的反应,恒容容器中充入适量He,总压强增大,但气体分压不变,平衡不发生移动,故B错误;
C、加入催化剂,反应速率增大,a、b的反应速率不等,达到的平衡状态相同,故C错误;
D、反应是一个气体体积增大的反应,在恒压容器加入He,为保持恒压条件增大使压强减小,正逆反应速率均减小,压强减小平衡向气体体积增大的方向进行,与图象符合,故D正确.
故选D.
点评 本题考查了化学反应速率的影响因素及其应用,判断图象问题一定要看准坐标和曲线的走势,化学平衡移动原理的理解和图象变化分析是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 将漫射日光照射到装有氯气和甲烷混合气体(体积比4:1)的装置上.
将漫射日光照射到装有氯气和甲烷混合气体(体积比4:1)的装置上.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 森林遇到乱砍滥伐,破坏了生态平衡 | |
| B. | 工业上大量燃烧含硫燃料 | |
| C. | 硫酸厂排出的大量气体 | |
| D. | 大气中CO2的含量增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发性的酸 | |
| C. | 常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应 | |
| D. | 在化学反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O中浓H2SO4只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加H2O | B. | 通入CO2 | C. | 通入SO2 | D. | 加少量NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
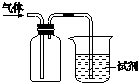
| A. | 该装置可用于收集NO2,试剂为水,用于吸收多余的NO2 | |
| B. | 若试剂是紫色石蕊试液,通入Cl2,溶液先变红后褪色,则氯气有漂白性 | |
| C. | 该装置可用于收集NH3,试剂为水,用于吸收多余的NH3 | |
| D. | 若试剂是酸性KMnO4溶液,通入SO2,溶液褪色,则得出SO2有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
. .
. 、
、 .
. 、
、
 +
+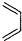 $\stackrel{△}{→}$
$\stackrel{△}{→}$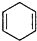 ,如果要合成
,如果要合成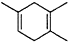 所用的原始原料可以是AC
所用的原始原料可以是AC查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com