
| A. | 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA | |
| B. | 常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.01NA | |
| C. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA | |
| D. | 7.8 g Na2O2中含有的阴离子数为0.2NA |
分析 A、根据 C2H4、C3H6的最简式为CH2来分析;
B、溶液的体积不明确;
C、求出丙烷的物质的量,然后根据1mol丙烷中含10mol共价键来分析;
D、求出Na2O2的物质的量,而1molNa2O2中含1mol过氧根.
解答 解:A、C2H4、C3H6的最简式为CH2,故14g混合物中含有的CH2的物质的量n=$\frac{14g}{14g/mol}$=1mol,故含1mol碳原子,故A正确;
B、溶液的体积不明确,故溶液中的OH-的物质的量无法计算,故B错误;
C、标况下,0.56L丙烷的物质的量n=$\frac{0.56L}{22.4L/mol}$=0.025mol,而1mol丙烷中含10mol共价键,故0.025mol丙烷中含0.25mol共价键,故C错误;
D、7.8gNa2O2的物质的量n=$\frac{7.8g}{78g/mol}$=1mol,而1molNa2O2中含1mol过氧根,故0.1mol过氧化钠中含0.1mol过氧根,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
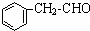 )主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90.
)主要存在于烟叶中,有浓郁的玉簪花香气,用于合成香料.现有如下转化关系,其中C能使溴的四氯化碳溶液褪色,E继续被氧化生成F,F的相对分子质量为90. $\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E
$\stackrel{HCN}{→}$A$→_{H_{2}O}^{HCl}$B$→_{△}^{浓H_{2}SO_{4}}$C$→_{②Zn/H_{2}O}^{①O_{3}}$D+E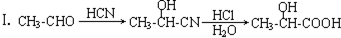
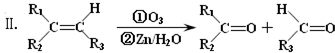
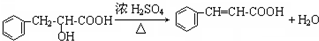 ;该反应类型属消去反应.
;该反应类型属消去反应.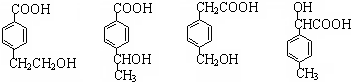 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
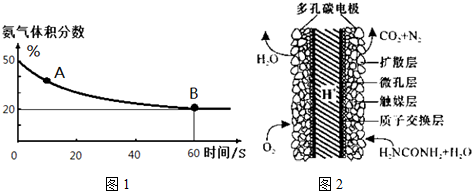
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| C. | 糖类、油脂和蛋白质都是高分子化合物,都能发生水解反应 | |
| D. | 蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com