
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,A的一种单质在自然界中硬度最大,则A为碳元素;同周期中,C元素的最高价氧化物对应的水化物的碱性最强,处于ⅠA族,原子序数大于碳,故C为Na;B元素的第一电离能比同周期相邻两个元素都大,处于ⅡA族或ⅤA族,而B的原子序数介于碳、钠之间,故B为N元素;D的基态原子M层电子数是K层的2 倍,则其M层电子数为4,故D为Si;E与C位于不同周期,原子序数大于Si,则E处于第四周期,E原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则E为Cu,据此解答.
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加,A的一种单质在自然界中硬度最大,则A为碳元素;同周期中,C元素的最高价氧化物对应的水化物的碱性最强,处于ⅠA族,原子序数大于碳,故C为Na;B元素的第一电离能比同周期相邻两个元素都大,处于ⅡA族或ⅤA族,而B的原子序数介于碳、钠之间,故B为N元素;D的基态原子M层电子数是K层的2 倍,则其M层电子数为4,故D为Si;E与C位于不同周期,原子序数大于Si,则E处于第四周期,E原子核外最外层电子数与C相同,其余各层电子均充满,原子核外电子数=2+8+18+1=29,则E为Cu.
(1)E为Cu,在周期表中位于第四周期第ⅠB族,C为Na,基态原子核外电子排布式是:1s22s22p63s1,
故答案为:四、ⅠB;1s22s22p63s1;
(2)A、B、D三元素分别为C、N、Si,同周期随原子序数增大电负性增大,同主族自上而下电负性减小,故电负性由大到小顺序为:N>C>Si,其中A的最高价氯化物为CCl4,为正四面体结构,分子中正负电荷重心重合,属于非极性分子,
故答案为:N>C>Si;非极性分子;
(3)A、B的最简单氢化物分别为CH4、NH3,由于NH3分子间存在氢键,其沸点高于CH4的,
故答案为:NH3;NH3分子间存在氢键;
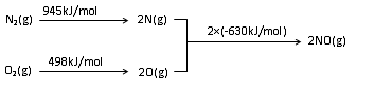
(4)已知:①、CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
②、2NO2(g)?N2O4(g)△H2=-56.9kJ/mol
由盖斯定律,①-②得:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
点评 本题考查结构性质位置关系应用,题目比较综合,涉及核外电子排布、电负性、热化学方程式等,侧重考查学生对知识的迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 | |
| D. | 将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为AgS | |
| B. | 银针验毒时,空气中氧气发生氧化反应 | |
| C. | 反应中Ag和H2S均是还原剂 | |
| D. | 每生成1mo1X会转移2mo1电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿天气,NF3泄漏常常容易察觉 | |
| B. | 一旦NF3泄露,可以用石灰水溶液喷淋的方法减少污染 | |
| C. | 上述反应中,被还原与被氧化的元素的物质的量之比为2:1 | |
| D. | 若生成22.4L(标准状况)NO气体,反应转移的电子数目为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子半径 | 电负性 | 第一电离能 | 沸点 |
| O2->Al3+ | C<N | N>O | CH4< NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向2mL 2%CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后滴加M溶液,加热 | 未出现砖红色沉淀 | M中不含醛基 |
| B | 在CuSO4溶液中介入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| C | 向有机试剂N中加入2mL5%的NaOH溶液,加热,冷却后取上层溶液滴加几滴AgNO3溶液 | 出现褐色沉淀 | N不是卤代烃 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2已氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
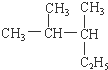 2,3-二甲基戊烷
2,3-二甲基戊烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com