
| A. | 用托盘天平称取3.2gNaCl固体 | B. | 用10mL量筒量取7.5mL稀盐酸 | ||
| C. | 用450mL的容量瓶配制450mL溶液 | D. | 用广泛pH试纸测得某溶液的pH为3 |
分析 A.托盘天平精确到0.1g;
B.量筒精确到0.1mL;
C.实验室没有450mL容量瓶,只能选用500mL容量瓶配制溶液;
D.广泛pH试纸的精确度只能达到1.
解答 解:A.游码的精确度为0.1g,可用托盘天平称取3.2gNaCl固体,故A正确;
B.量筒量程选择的依据有两点:一是保证测量一次,二是量程要与液体的取用量最接近,应用10mL量筒量取7.5mL稀盐酸,故B正确;
C.由于实验室没有450mL容量瓶,采用大而近的原则,可以用500mL的容量瓶配制450mL溶液,故C错误;
D.广泛pH试纸只能测量整数值,用广泛pH试纸测得某溶液的pH为3,故D正确;
故选C.
点评 本题考查了计量仪器及其使用方法,解答本题的关键是记住量筒、广泛pH试纸、托盘天平的准确度,只要记住了准确度,就能很容易地判定所给出数据的合理性,注意容量瓶选择采用大而近的原则,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
如图两瓶体积相等的气体在同温同压时瓶内气体关系一定正确的是( )
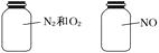
A.相同的质量 B.相同的摩尔质量
C.相同的密度 D.相同的原子数
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁表面发生析氢腐蚀时,钢铁表面水膜的pH增大 | |
| B. | 电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量少 | |
| C. | 在镀件上电镀锌,可以用锌作阳极,用硫酸锌溶液作电解质溶液 | |
| D. | 原电池的负极和电解池的阴极上都是发生失电子过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个甲基,可能生成4种一氯代物 | B. | 3个甲基,可能生成3种一氯代物 | ||
| C. | 3个甲基,可能生成5种一氯代物 | D. | 4个甲基,可能生成4种一氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的平均摩尔质量 | B. | 混合气体的密度 | ||
| C. | A物质的质量 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}、高温}{→}$SiCl4$\stackrel{H_{2}、高温}{→}$Si | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2 $\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2 | |
| B. | 一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA | |
| C. | 常温下18 g铝放入足量浓硫酸中转移电子数2 NA | |
| D. | 1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
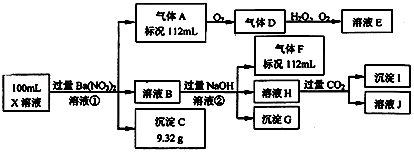
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的CH4在反应①、②中转移电子数相同 | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1. | |
| C. | 4NO2(g)+2N2(g)=8NO(g);△H=+586 kJ•mol-1 | |
| D. | 若用标准状况下4.48LCH4把NO2还原为N2,整个过程中转移1.6mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com