
����Ŀ��Fe��Co��Ni��Ϊ�ڢ���Ԫ�أ����ǵĻ����������������������Ź㷺��Ӧ�á�
��1����̬Coԭ�ӵļ۵����Ų�ʽΪ_______��Co2������3d�ܼ�����_____�ԳɶԵ��ӡ�
��2��Co3����һ��������[Co(N3)(NH3)5]2���У�Co3������λ����________��1 mol��������������������ĿΪ________����λ��N3-����ԭ�ӵ��ӻ�����Ϊ________��
��3��Co2����ˮ��Һ����[Co(H2O)6]2�����ڡ���Co2������Һ�м��������ˮ�����ɸ��ȶ���[Co(NH3)6]2������ԭ����_________________________________________________��
��4��ij��ɫ���徧��ṹ��ͼ��Fe2����Fe3���ֱ�ռ�������廥�����ڵĶ��㣬���������ÿ�����Ͼ���һ��CN����K��λ��������������ϡ��ݴ˿�֪�þ���Ļ�ѧʽΪ________����������Fe2�������������γɵĿռ乹����________��K����ȱ�ʣ�������û��K����ռ�����ĵİٷֱȣ�Ϊ_____________��
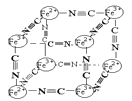
��5��NiO�ľ����ṹ��ͼ����ʾ������ԭ���������AΪ(0,0,0)��BΪ(1,1,0)����Cԭ���������Ϊ________��
ͼ�� ͼ��
��6��һ���¶��£�NiO��������Է��ط�ɢ���γ��������Ӳ�����������ΪO2�������õ������У�Ni2���������(��ͼ��)����֪O2���İ뾶Ϊa pm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ________g(�ú�a��NA�Ĵ���ʽ��ʾ)��
���𰸡�3d74s2 2 6 23NA sp NԪ�ص縺�Ա�OԪ�ص縺��С��Nԭ���ṩ�µ��ӶԵ����������Co2���γɵ���λ����ǿ KFe2(CN)6 ���������� 50% (1��![]() ��
��![]() )
) ![]()
��������
��1��COԭ�ӵĺ˵����Ϊ27����̬CO�ļ۵����Ų�ʽΪ3d74s2��Co2+��������Ų�Ϊ3d7��3d�ܼ�����2�ԳɶԵ��ӣ�
��2���������Ӻ�N3-�е�ԭ�����йµ��Ӷԣ��ܹ���Co+�γ���λ��������5�������Ӻ�1��N3-���ӣ���Co+�γɵĵ���λ��Ϊ6������5 mol���������ṩ����Ϊ15mol��1 mol N3-�к�������2 mol���γ���λ����6 mol������1mol ��������������������ĿΪ23NA���ӻ������=����ԭ�ӵŵ��Ӷ���+����ԭ�ӵ���������Ŀ������N3-���ĵ�ԭ�ӹµ��Ӷ���Ϊ0����������ĿΪ2�������ӻ������Ϊ2������sp�ӻ���
��3��Co2+��ˮ��Һ����[Co(H2O)6]2+���ڡ���Co2+����Һ�м��������ˮ�����ɸ��ȶ���[Co(NH3)6]2+ ����ԭ����NԪ�ص縺�Ա�OԪ�ص縺��С��Nԭ���ṩ�µ��ӶԵ����������Co2+�γɵ���λ����ǿ��
��4��Fe2+��Fe3+ռ��������Ļ������ڵĶ��㣬��ÿ������������4��Fe2+��4��Fe3+�����ݾ���Ŀռ�ṹ�ص㣬ÿ�������ϵ�������1/8���ڸ������壬�������������1/2��Fe2+��1/2��Fe3+��CN-λ������������ϣ����ϵ�����1/4���ڸ������壬������������3��CN-�����Ըþ���Ļ�ѧʽΪ [FeFe(CN)6]-���������ʳʵ����ԣ�������Ҫһ����������֮��ϣ����Ըþ���Ļ�ѧʽΪKFe2(CN)6����������Fe2+�����������γɵĿռ乹�������������Σ�
��5����NiO�����������������AΪ��0��0��0����BΪ��1��1��0��������ͼ�ɿ���C����������xΪ1����yΪ![]() ����zΪ
����zΪ![]() �����������Ϊ��1��
�������������1��![]() ��
��![]() ����
����
��6�����ݽṹ֪�������Ӻ����ڵ�������֮��ľ���Ϊ2a��������������������Ӻ˼�ľ����Ǿ�������������Ӻ������Ӿ����![]() ���������������2
���������������2![]() am������ͼƬ֪��ÿ����������ռ�����=2a m��2a m��sin60���10-24����ÿƽ�����е�����������=1/(2a m��2a m��sin60���10-24)=
am������ͼƬ֪��ÿ����������ռ�����=2a m��2a m��sin60���10-24����ÿƽ�����е�����������=1/(2a m��2a m��sin60���10-24)=![]() ��1024��ÿ��������������=
��1024��ÿ��������������=![]() g������ÿƽ�����е�����������=
g������ÿƽ�����е�����������=![]() ��
��![]() ��1024=
��1024=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪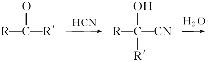
 ��������ӱ�ԭ��������Ӷ�һ��̼ԭ�ӣ�������̼����������ͼ�仯�����ش��й����⣺
��������ӱ�ԭ��������Ӷ�һ��̼ԭ�ӣ�������̼����������ͼ�仯�����ش��й����⣺
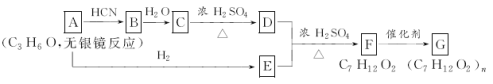
(1)д���й����ʵĽṹ��ʽ��A��____________��C��________________��
(2)ָ����Ӧ���ͣ�C��D��___________��F��G��________________��
(3)д�����з�Ӧ�Ļ�ѧ����ʽ��D��E��F��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij��ѧ��ȤС��̽����ͬ�����»�ѧ��ת��Ϊ���ܵ�װ�á���ش��������⣺
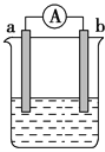
(1)���缫aΪZn���缫bΪʯī�����������ҺΪϡ����ʱ���õ�صĸ����ĵ缫��ӦʽΪ��___������Ӧ���ռ�����״����672 mL����ʱ���������ת�Ƶĵ�����ĿΪ____��
(2)�����һȼ�ϵ�أ��Ե缫aΪ�������缫bΪ�������״�(CH4O)Ϊȼ�ϣ���������������ҺΪ�������Һ��������Ӧͨ��____��(����a������b��)����һ�缫�ĵ缫��Ӧʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��Ӧ��2Ag+(aq)��Cu(s)=Cu2+(aq)��2Ag(s)��Ƶ�ԭ�����ͼ����ش��������⣺
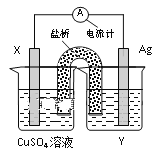
��1���缫X�IJ���������___���������ҺY���ʵĻ�ѧʽ��___��
��2�����缫Ϊ��ص�___���������ĵ缫��ӦΪ___��
��3�����·�еĵ����Ǵ�___�缫����___�缫��(��缫��������)��
��4������1.6gͭ�ܽ�ʱ����������___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ա�Ϊԭ�Ͽ��Ժϳ��йز�Ʒ����������ͼ��
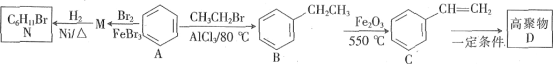
�ش��������⣺
��1��B��������____��
��2��1��C���������___��ԭ�ӹ�ƽ�档
��3��A��M�ķ�Ӧ������___��C�й�����������___��
��4��д��M��N�Ļ�ѧ����ʽ��____��
��5��N��һ�ȴ�����____�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�ǽ���ϳɵ�һ���л�����ķ��ӽṹ�ɼ�ʾΪ![]() (����C��Hԭ������ȥ)�����й�����ϩ��˵���д������( )
(����C��Hԭ������ȥ)�����й�����ϩ��˵���д������( )
A. ��ϩ�DZ���һ��ͬ���칹��
B. ��ϩ���������е�̼ԭ�Ӳ�������ͬһƽ����
C. ��ϩ����ϩ��һ��ͬϵ��
D. ��ϩ��һ�������¿��Է����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
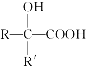
����Ŀ����֦������������о�����ṹ��ʽ��ͼ�����й��ڷ�֦���������ȷ����

A. �����к���2�ֹ�����
B. �����Ҵ������ᷴӦ���ҷ�Ӧ������ͬ
C. 1mol��֦��������3molNaOH�����кͷ�Ӧ
D. ��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NAΪ�����ӵ�������ֵ����������������м����� ��
��BF3��CCl4������ԭ�Ӿ��ﵽ�����8�����ȶ��ṹ
��46g SiO2�к��й��ۼ�����ĿΪNA
��2g H218O��D2O�Ļ�����У����еĵ�����ΪNA
��K2SO4����ˮ�Ĺ����������Ӽ������ۼ��Ķ���
��78g Na2O2���������ӵ���ĿΪ4NA
��18g D2O����������10NA
��1mol NH5�к���5NA��N��H������֪NH5������ԭ�Ӷ��ﵽϡ��������ȶ��ṹ��
A.3B.4C.5D.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. 25 ��ʱ0.1molL��1NH4Cl��Һ��Kw����100��ʱ0.01molL��1NaCl��Һ��Kw
B. �����£�pH��Ϊ3�Ĵ����������������Һ�У���ˮ�������������Ũ��֮��Ϊ1��108
C. ������Һ��pH������ԵĹ�ϵ���Ƴ�pH��6.5����Һһ��������
D. �����£���pH��2��������pH��12�İ�ˮ�������ϣ���Һ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com