
| A. | 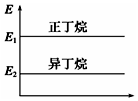 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
分析 ①CH3CH2CH2CH3(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2878kJ/mol,
②(CH3)2CHCH3(g)+$\frac{13}{2}$O2(g)=4CO2(g)+5H2O(l)△H=-2869kJ/mol,
①-②得到CH3CH2CH2CH3(g)=(CH3)2CHCH3(g)△H=-9KJ/mol,可见正丁烷分子的能量高于异丁烷能量,以此解答该题.
解答 解:由题给信息可知CH3CH2CH2CH3(g)=(CH3)2CHCH3(g)△H=-9KJ/mol,
A.正丁烷分子的能量高于异丁烷能量,则正丁烷与异丁烷的能量大小关系如图,故A正确;
B.能量越高越不稳定,正丁烷不稳定,故B错误;
C.正丁烷分子的能量高于异丁烷能量,则异丁烷转化为正丁烷的过程是一个吸热过程,故C错误;
D.正丁烷和异丁烷分子式相同,含有相同的C-H键,故D错误.
故选A.
点评 本题考查了热化学方程式的应用,为高频考点,侧重于学生的分析能力的考查,注意把握物质的能量高低比较与物质稳定性的关系,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极发生氧化反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,溶液中存在的金属阳离子只有Ni2+和Zn2+ | |
| C. | 电解后溶液中Ni2+数目减少 | |
| D. | 电解后,电解槽底部的阳极泥中有Pt和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com