
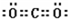 共价键;
共价键;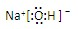 ,离子键,共价键;
,离子键,共价键; ,共价键;
,共价键;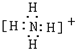 ,共价键.
,共价键. 分析 (1)二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对;
(2)氢氧化钠为离子化合物,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键,电子式中需要标出阴阳离子所带电荷;
(3)氨气是四核10电子的共价化合物,分子中每个氢原子和氮原子形成一个共用电子对;
(4)五核10电子的阳离子NH4+,NH4+为复杂阳离子,氮原子与氢原子存在共价键,电子式中要带电荷,并用[],电子式为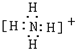 .
.
解答 解:(1)二氧化碳分子中每个氧原子和碳原子形成两个共用电子对,每个氧原子含有2个孤电子对,二氧化碳分子的电子式为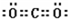 ;
;
故答案为: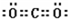 ;共价键;
;共价键;
(2)氢氧化钠中存在钠离子和氢氧根离子,电子式需要标出阴阳离子所带电荷,氢氧化钠的电子式为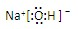 ,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键;
,钠离子与氢氧根离子存在离子键,氢氧根离子中氧原子和氢原子存在共价键;
故答案为: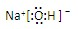 ,离子键,共价键;
,离子键,共价键;
(3)氨气是四核10电子的共价化合物,氨气分子中每个氢原子和氮原子形成一个共用电子对,所以氨气分子的电子式为 ;
;
故答案为: ,共价键;
,共价键;
(4)五核10电子的阳离子NH4+,NH4+为复杂阳离子,氮原子与氢原子存在共价键,电子式中要带电荷,并用[],电子式为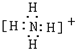 ;
;
故答案为: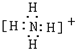 ,共价键.
,共价键.
点评 本题主要考查了电子式的书写、化学键的判断,难度不大,注意电子式的书写方法,注意离子和原子、分子电子式的不同.


科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g)?2Z(g)+4W(?)△H<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量).
在1.5L的密闭容器中通入2molX2和3molY2的混合气体,在一定条件下发生反应:X2(g)+3Y2(g)?2Z(g)+4W(?)△H<0达到平衡时,容器内压强为反应开始时的0.8(相同温度下测量).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

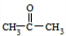 +2H2O;
+2H2O;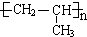 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂 | B. | 酸化剂 | C. | 还原剂 | D. | 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是直线形结构 | |
| B. | 中心原子都采取sp3杂化轨道 | |
| C. | SO2中S原子和SO3中S原子上都没有孤对电子 | |
| D. | SO2为V形结构,SO3为平面三角形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
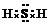 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+) | B. | c(H+)>c(OH-) | ||
| C. | 2 c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2 c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com