
| A. | NaNO3→NaCl | B. | SO3→H2SO4 | C. | MgO→Mg(OH)2 | D. | CaCO3→Ca(OH)2 |
分析 一步反应实现即原物质只发生一个反应即可转化为目标物质,根据所涉及物质的性质,分析能否只通过一个反应而实现即可.
解答 解:A、由NaNO3转化为NaCl,假设能反应,对应的是硝酸盐和钠盐,而硝酸盐和钠盐均是可溶性盐,不符合复分解反应的条件,转化不能由一步反应实现,故A错误;
B、三氧化硫与水反应生成硫酸,能一步实现,故B正确;
C、氧化镁不溶于水,所以氧化镁先与酸反应,再与碱发生复分解反应生成氢氧化镁,不能一步转化,故C错误;
D、碳酸钙是不溶性的盐,与碱不反应,所以不能一步转化为氢氧化钙,故D错误;
故选B.
点评 本题有一定难度,熟练掌握所涉及物质的性质、抓住关键词“能否一步实现”是解决此类问题的关键.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、硫酸钠 | D. | 磷酸、生石灰、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯 乙二醇: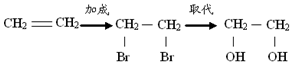 | |
| B. | 溴乙烷 乙醇:CH3CH2Br$\stackrel{水解}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷 1,3-丁二烯: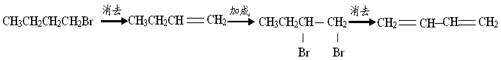 | |
| D. | 乙烯 乙炔: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>I2>S | B. | Cl2>I2>Fe3+>S | C. | Cl2>Fe3+>S>I2 | D. | Fe3+>I2>C12>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.10 mol/L CH3 COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个,则可证明醋酸是弱电解质 | |
| C. | 取等体积等浓度的CH3 COOH和盐酸溶液,分别加入Na2CO3固体,若醋酸溶液产生气体多,证明醋酸为弱电解质 | |
| D. | 测相同浓度盐酸和醋酸的导电性,醋酸溶液的导电性明显弱于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g氢气中含有的原子数是2mol | |
| B. | 4g氢气所占的体积是44.8L | |
| C. | 4g氢气的物质的量是2mol | |
| D. | 4g氢气与44.8L氧气所占有的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com