
| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A�� | ��Ӧǰ3min��ƽ������v��Z��=2.0��10-5 mol/��L•min�� | |
| B�� | �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv��������v���棩 | |
| C�� | �����¶ȣ��÷�Ӧ��ƽ�ⳣ�������� | |
| D�� | �����������䣬�ٳ���0.2molZ��ƽ��ʱX������������� |
���� 3minʱ�ﵽƽ�⣮��ʱY�����ʵ���Ϊ0.10mol����
X��g��+Y��g��?2Z��g��
��ʼ 0.16 0.16 0
ת�� 0.06 0.06 0.12
ƽ�� 0.10 0.10 0.12
A�����v=$\frac{��c}{��t}$���㣻
B�������¶ȣ�����ȵķ����ƶ���
C���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
D���¶ȡ�������䣬�÷�ӦΪ�����������ķ�Ӧ���ٳ���0.2molZ����ԭƽ��Ϊ��Чƽ�⣮
��� �⣺A����Ӧǰ3min��ƽ������v��Z��=$\frac{\frac{0.12mol}{10L}}{3min}$=4.0��10-3 mol/��L•min������A����
B���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ�����Ӧ�ﵽ��ƽ��ǰv��������v���棩����B��ȷ��
C���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���K=$\frac{{c}^{2}��Z��}{c��X��c��Y��}$��С����C����
D���¶ȡ�������䣬�÷�ӦΪ�����������ķ�Ӧ���ٳ���0.2molZ������ת��Ϊ��Ӧ�X��Y�����ʵ�������Ϊ1��1����ԭƽ��Ϊ��Чƽ�⣬��ƽ��ʱX������������䣬��D����
��ѡB��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬����ƽ�����η���K�����ʵļ��㡢ƽ���ƶ�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ѡ��DΪ�����ѵ㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol/L | B�� | 2 mol/L | C�� | 0.5 mol/L | D�� | 1.5 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
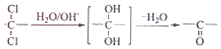
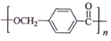 ��·�ߣ�
��·�ߣ�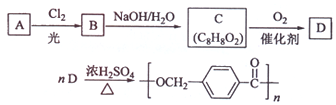
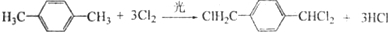 ��
��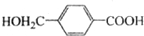 ����D�ϳɾ�����߷��Ӳ���
����D�ϳɾ�����߷��Ӳ��� 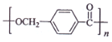 �Ļ�ѧ����ʽ��n
�Ļ�ѧ����ʽ��n $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$ +��n-1��H2O
+��n-1��H2O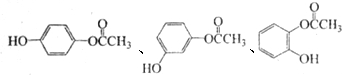 ��д�ṹ��ʽ����
��д�ṹ��ʽ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
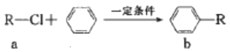 ���˷�Ӧ�Ǻϳɷ����廯�����һ����Ҫ�������л���a�ͱ�ͨ�����˷�Ӧ�ϳ�b�Ĺ��̱�ʾ���£���С���Ӳ�����ȥ��������˵���в���ȷ���ǣ�������
���˷�Ӧ�Ǻϳɷ����廯�����һ����Ҫ�������л���a�ͱ�ͨ�����˷�Ӧ�ϳ�b�Ĺ��̱�ʾ���£���С���Ӳ�����ȥ��������˵���в���ȷ���ǣ�������| A�� | �÷�Ӧ��ȡ����Ӧ | |
| B�� | ��RΪCH3ʱ��a�ĵ���ʽΪ | |
| C�� | ��RΪC4H9ʱ��b�Ľṹ������4�� | |
| D�� | ��RΪC4H20ʱ��1 mol b������5 mol H2�ӳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���淴Ӧ�ﵽƽ��״̬�ı��������������Ӧ���ʷ����仯����ƽ��һ�������ƶ� | |
| B�� | �������ѧ��Ӧ��һ�������¶���һ���� | |
| C�� | ʹ�ô����ɽ��ͷ�Ӧ��ܣ��ӿ췴Ӧ���ʣ��ı䷴Ӧ�� | |
| D�� | FeCl3��Һ��KSCN��Һ��Ӧ�ﵽƽ��ʱ����������KCl��Һ����K+��Cl-һֱ����Һ�д��ڣ�������Һ��ɫ����仯 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com