
 、
、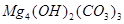 、
、 等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
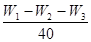 :
: :
: 确定碱式碳酸镁的组成。
确定碱式碳酸镁的组成。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
 Na2SO4 + SO2↑+ H2O,据此设计如下图所示装置进行相关实验。
Na2SO4 + SO2↑+ H2O,据此设计如下图所示装置进行相关实验。 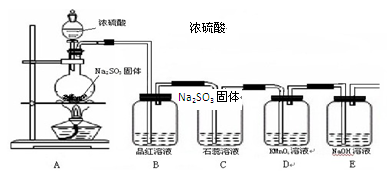
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向AlCl3溶液中加入过量的氨水,过滤,洗涤,干燥,加热灼烧 | 制取Al2O3 |
| B | 将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水 | 检验气体产物中的CO2 |
| C | 向某溶液中加入NaOH溶液后再加热,若产生的气体能使湿润的红色石蕊试纸变蓝, | 验证该溶液中肯定有NH4+ |
| D | 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的溶液,恢复红色 | 验证亚硫酸的不稳定性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 将少量某无色气体通入澄清石灰水 | 出现白色沉淀 | 该气体一定是CO2 |
| C | 分别用测定常温下0.1 mol·L--1 Na2SiO3和Na2CO3的PH | PH:Na2SiO3﹥Na2CO3 | 非金属性Si﹥C |
| D | 向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中, 滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 水解液
水解液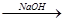 中和液
中和液 溶液变蓝
溶液变蓝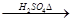 水解液
水解液 无红色沉淀
无红色沉淀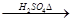 水解液
水解液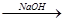 中和液
中和液 有红色沉淀
有红色沉淀查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2 


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
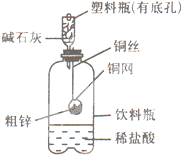
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑤ | B.②③⑤ | C.②③④⑤ | D.全部都可以 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com