
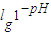 ;
;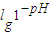 ,所以pH=4.5的番茄汁中c(H+)与pH=6.5的牛奶中c(H+)之比=
,所以pH=4.5的番茄汁中c(H+)与pH=6.5的牛奶中c(H+)之比=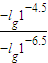 =100,故A正确;
=100,故A正确;

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
| A、PH值相同的盐酸和氯化铵溶液中水的电离程度相同 | B、某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13 | C、PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的2倍 | D、中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com