
【题目】常温下,下列化肥的水溶液pH>7的是
A. K2SO4 B. K2CO3 C. NH4Cl D. NH4NO3
科目:高中化学 来源: 题型:
【题目】向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使反应N2+3H2 ![]() 2NH3发生,有关说法正确的是( )
2NH3发生,有关说法正确的是( )
A. 达到化学平衡时,N2将完全转化为NH3
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1温度下若由a点达到平衡,可以采取增大压强的方法
D. 在达到平衡的过程中,c点v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度
C.增大O2浓度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)=2AB2(g) (A2、B2、AB2的结构式分别为A=A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是
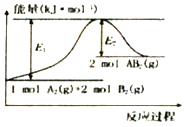
A. 该反应若生成2molAB2(g)则吸收的热量为(El-E2)kJ
B. 该反应的进行一定需要加热或点燃条件
C. 该反应断开化学键消耗的总能量小于形成化学键释放的总能量
D. 生成2molB-B键放出E2kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示。
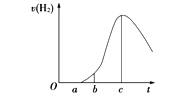
请回答下列问题。
(1)曲线由O→a段不产生氢气的原因是____________________。
有关反应的化学方程式为_________________________。
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是_______________________________。
(3)曲线由c以后产生氢气的速率逐渐下降的主要原因是_______________________________。
II.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有:______________、_________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com