
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L﹣1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是()
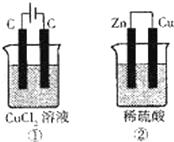
A. 产生气体的体积:①>②
B. 两极上析出物质的质量:①>②
C. 溶液的pH变化:①增大,②减小
D. 电极反应式:①中阳极:4OH﹣﹣→2H2O+O2↑+4e﹣;②中阴极:2H++2e﹣﹣→H2↑
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: ①有外接电源,所以是电解池,阳极反应为2Cl﹣﹣2e﹣=Cl2↑,阴极反应为:Cu2++2e﹣=Cu,②为原电池,正极反应为2H++2e﹣=H2↑,负极反应为Zn﹣2e﹣=Zn2+,以此解答该题.
解答: 解:A、①的阳极反应:2Cl﹣﹣2e﹣=Cl2↑,导线中通过0.02mol电子时,产生氯气的体积V=nVm=0.01mol×22.4L/mol=0.0224L,②中的正极反应为:2H++2e﹣=H2↑,导线中通过0.02mol电子时,产生氢气的体积V=nVm=0.01mol×22.4L/mol=0.0224L,所以产生气体的体积:①=②,故A错误;
B、①中阴极生成铜,②生成氢气,则电极上析出物质的质量:①>②,故B正确;
C、①相当于电解氯化铜,溶液的pH几乎不变,②相当于锌和硫酸中的氢离子反应,所以氢离子减少,酸性减弱,所以pH增大,故C错误;
D、①中阳极:2Cl﹣﹣2e﹣=Cl2↑,②中的正极反应为:2H++2e﹣=H2↑,故D错误.
故选B.
点评: 本题是一道有关原电池和电解池的工作原理的综合题目,要求学生熟悉教材基本知识,具备分析和解决问题的能力.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L 的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是()
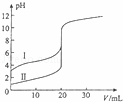
A. Ⅱ表示的是滴定醋酸的曲线
B. PH=7时,滴定醋酸消耗V(NaOH)小于20ml
C. V(NaOH)=20ml时,C(Cl﹣)=C(CH3COO﹣)
D. V(NaOH)=10ml时,醋酸溶液中:C(Na+)>C(CH3COO﹣ )>C(H+)>C(OH﹣ )
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Zn(s)+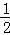 O2(g)═ZnO(s)△H=﹣350kJ/mol,则1g Zn在氧气中燃烧放出的热量约为()
O2(g)═ZnO(s)△H=﹣350kJ/mol,则1g Zn在氧气中燃烧放出的热量约为()
A. 5.4 kJ B. 350 kJ C. 3.5 kJ D. 8.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是一个电解装置图,某实验兴趣小组做完实验后,在读书卡片上写下了一些记录:()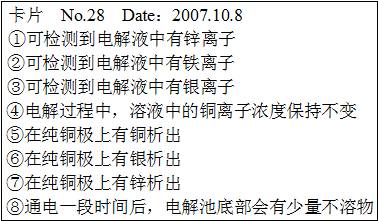 卡片上描述合理的是(已知粗铜中除含有铜以外,还含有少量锌、铁、银)
卡片上描述合理的是(已知粗铜中除含有铜以外,还含有少量锌、铁、银)
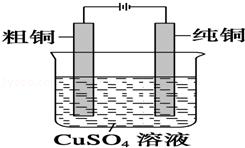
A. ①②⑤⑧ B. ①⑤⑧ C. ①②④⑤⑧ D. ③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解物质的量浓度相同、体积比为1:3的CuSO4和NaCl的混合溶液,可能发生的反应有()
①2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl﹣ Cu+Cl2↑
Cu+Cl2↑
③2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑
2OH﹣+H2↑+Cl2↑
④2H2O 2H2↑+O2↑
2H2↑+O2↑
A. ①②③ B. ①②④ C. ②③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
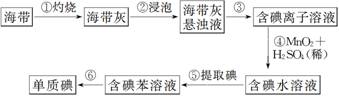 下图为实验室从海带中提取碘单质的流程示意图,判断下列说法错误的是
下图为实验室从海带中提取碘单质的流程示意图,判断下列说法错误的是
A. 步骤①需要用到蒸发皿 B. 步骤③需要过滤装置
C. 步骤⑤需要用到分液漏斗 D. 步骤⑥需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某催化剂可将汽车尾气中的CO、NO转化为无毒气体。已知:
2CO(g)+O2(g)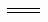 2CO2(g) ΔH=akJ·mol-1
2CO2(g) ΔH=akJ·mol-1
N2(g)+O2(g)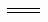 2NO(g) ΔH=b kJ·mol-1
2NO(g) ΔH=b kJ·mol-1
①反应2NO(g)+ 2CO(g) 2CO2(g) +N2(g) ΔH=_________kJ·mol-1。
2CO2(g) +N2(g) ΔH=_________kJ·mol-1。
②可以利用反应:NO2+G N2+H2O+nX(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
N2+H2O+nX(n可以为零)将NO2变成无害N2,若要求X必须为无污染的物质,则G可以是_________(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
当反应中转移1.2mol电子时,消耗NO2__________L(标准状况)。
③用NaOH溶液吸收工业尾气中的SO2最终制得石膏(CaSO4.2H2O)。为节约资源减少排放实现物质的循环利用,生产过程中还需要加入的固体物质是____________(填化学式)。
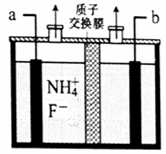
(2)工业上通过电解含NH4F的无水熔融物生产NF3气体,其电解原理如图所示。则a极为___________极,该极的电极反应式_______________________________________。
(3)用电镀法在铁板表面镀锌或锡可防腐,这种防止金属腐蚀的方法从原理上属于________________法。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com