
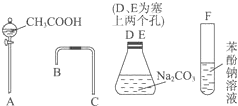
 设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH. .
. 分析 (1)将A中的CH3COOH与Na2CO3发生反应生成大量气体二氧化碳,说明酸性CH3COOH>H2CO3;产生的CO2气体通入苯酚钠溶液发生反应生成苯酚:说明酸性H2CO3>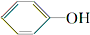 ;
;
(2)CH3COOH与Na2CO3反应生成二氧化碳和醋酸钠、水;二氧化碳与苯酚钠反应生成碳酸氢钠和苯酚.
解答 解:(1)醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH,根据强酸制取弱酸知,醋酸和碳酸钠反应制取二氧化碳,二氧化碳和苯酚钠溶液反应制取苯酚,所以仪器的连接顺序是:A→D→E→A→B→C→F,
故答案为:A;D;E;B;C;F;
(2)CH3COOH与Na2CO3反应生成二氧化碳和醋酸钠、水,则其反应方程式为:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,二氧化碳与苯酚钠反应生成碳酸氢钠和苯酚,其反应方程式为 ,
,
故答案为:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑; .
.
点评 本题考查了探究顺序强弱实验,明确物质的性质是解本题关键,结合强酸制取弱酸实验原理来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 四种物质中分别加入氯水,均有红棕色液体生成 | |
| B. | 四种物质中加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| C. | 四种物质中加入NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成 | |
| D. | 乙发生消去反应得到两种烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 图3所示装置配制100mL0.1mol•L-1的硫酸 | |
| D. | 图4所示装置用于分离出溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 四种溶液中,水的电离程度①>②>④>③ | |
| B. | Na2CO3和NaHCO3 溶液中,粒子种类相同 | |
| C. | 将等浓度的CH3COOH 和HClO溶液比较,pH小的是HClO | |
| D. | Na2CO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
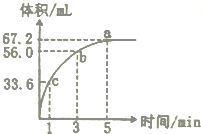 某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,
某“学习小组”研究影响化学反应速率的因素.向10 mL某浓度的H2O2溶解中加入一定量MnO2粉末,在标准状况下放出气体的体积和时间的关系如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的种类很多,但它们水解后都一定有一产物产生 | |
| B. | 淀粉、纤维素都属糖类,它们的通式相同,但它们不互为同分异构体 | |
| C. | 已知CH4+H2O$\stackrel{催化剂}{→}$CH3OH+H2该反应的有机产物是无毒物质 | |
| D. | C(CH3)4二氯代物只有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com