
| A. | 1mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| C. | 200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1molCu,转移电子的数目为2NA |
分析 A.二甲醚的结构简式为CH3OCH3,据此分析;
B.氢氟酸标况下为液体;
C.甲酸溶液中,甲酸和水都含氧;
D.在此反应中,每生成2mol铜,转移6mol电子.
解答 解:A.二甲醚的结构简式为CH3OCH3,则1mol二甲醚中含2molC-O键,即2NA条,故A正确;
B.氢氟酸标况下为液体,不能使用气体摩尔体积,故B错误;
C.甲酸溶液中,甲酸和水都含氧,所以200g质量分数为23%的HCOOH水溶液中含氧原子的总数目大于2NA,故C错误;
D.在此反应中,铜元素的化合价降低,S元素的化合价升高,氧元素的化合价降低,即Cu2S既做氧化剂又做还原剂,氧气做氧化剂,每生成2mol铜,转移6mol电子,即转移6NA个,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,主要是气体摩尔体积的条件应用,有机物结构的分析,微粒数的计算应用,掌握基础是解题关键,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:解答题
 世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.
世界卫生组织(WHO)确认人体中的14种必需微量元素中有铜、铬、硅、碘、氟等.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
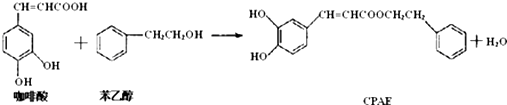
| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| C. | 与苯乙醇互为同分异构体的酚类物质共6种 | |
| D. | 1molCPAE与足量的NaOH溶液反应,最多消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的氢化物比同族氢化物的沸点均高 | |
| B. | X、Y、Z形成的化合物不止一种 | |
| C. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| D. | Y与Z或W形成的化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滤纸称量氢氧化钠固体 | |
| B. | 将溶解的氢氧化钠溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| C. | 定容时,俯视刻度线 | |
| D. | 定容后倒转容量瓶几次摇匀溶液,发现凹液面最低点低于刻度线,再补几滴水到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
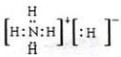 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com