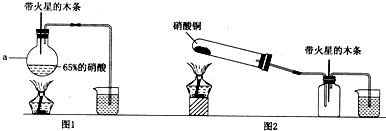
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
(1)请简述如何检查该装置的气密性.
将倒气管插入盛水的烧杯中,用手捂住圆底烧瓶(或用酒精灯微热圆底烧瓶),倒气管口有气泡冒出.冷却后,倒气管中产生水柱,一段时间没有变化,说明气密性良好
将倒气管插入盛水的烧杯中,用手捂住圆底烧瓶(或用酒精灯微热圆底烧瓶),倒气管口有气泡冒出.冷却后,倒气管中产生水柱,一段时间没有变化,说明气密性良好
.
(2)写出A装置中发生反应的离子方程式
MnO
2+4H
++2Cl
-Mn
2++C1
2↑+2H
2O
MnO
2+4H
++2Cl
-Mn
2++C1
2↑+2H
2O
.
(3)新制氯水能使红色布条退色.对于使红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种物质除水外都有可能.请你设计实验探究、验证,得出正确结论.
①提出假设,并进行实验探究、验证,分别简述实验的过程、现象和结论.
假设一:盐酸能使红色布条退色.探究、验证的实验过程、现象和结论为:
用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用
用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用
.
假设二:
氯气使红色布条退色
氯气使红色布条退色
.探究、验证的实验过程、现象和结论为:
把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用
把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用
.
假设三:HClO能使布条退色.本假设的实验探究、验证不做要求.
②得出的结论是
次氯酸使红色布条退色
次氯酸使红色布条退色
.
(4)某同学提出该装置需要进一步改进,请你写出改进的措施(或画出必要的装置图)
增加尾气吸收装置(或如图
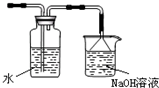
)
增加尾气吸收装置(或如图

)
.

 如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.
如图是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验. )
) )
) ,
, )
)

 阅读快车系列答案
阅读快车系列答案


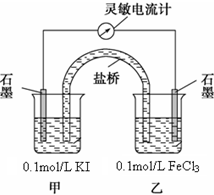 某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.
某研究性学习小组为证明2Fe3++2I-?2Fe2++I2为可逆反应(即反应存在一定的限度),设计如下几种方案.已知FeF63-是一种无色的稳定的络离子.