
| A. | 动物呼吸 | B. | 植物光合作用 | C. | 金属生锈 | D. | 石膏点制豆腐 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
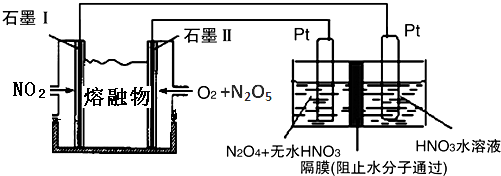
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷表现出一定的金属性 | B. | 砷在通常情况下是固体 | ||
| C. | 砷酸H3AsO4是一种氧化性强酸 | D. | 砷难与H2化合,砷化氢极不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
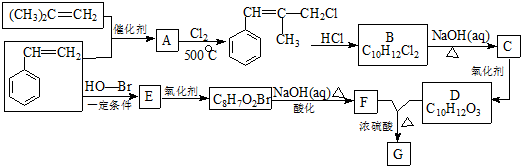
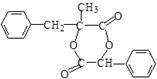 .
.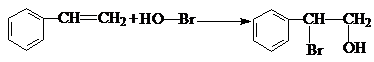 .
.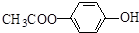 和
和 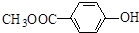 .
.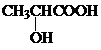 )的合成线路:
)的合成线路: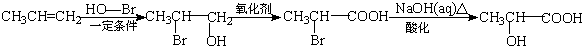 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol | B. | 10mol | C. | 7.5mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间 | |
| B. | 化学反应达到最大限度时,正逆反应速率也达到最大且相等 | |
| C. | 用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 | |
| D. | 用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com