
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 氢气在盛有氯气的集气瓶中燃烧,瓶口有白烟产生 | |
| C. | 氯气能与铁反应,液氯不宜贮存在钢瓶中 | |
| D. | 工业上以氯气和澄清石灰水为原料制造漂白粉 |
科目:高中化学 来源: 题型:解答题
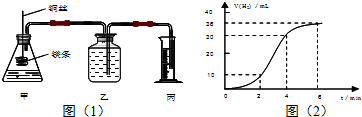
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
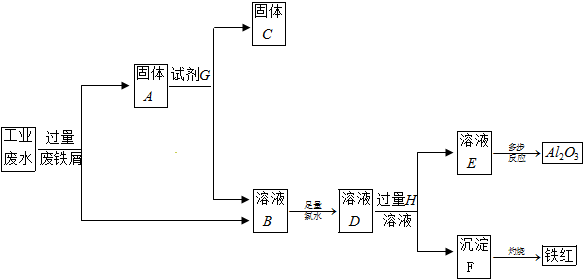
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
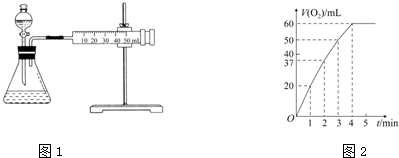
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 经测定某物质只含一种元素,则该物质一定是单质 | |
| B. | 阳离子、阴离子中均分别只含一种元素,则由这样的阴、阳离子组成的物质一定为纯净物 | |
| C. | 既能和酸反应又能和碱反应的化合物一定为两性化合物 | |
| D. | 酸性氧化物均可与强碱反应,碱性氧化物都是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
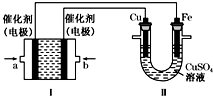 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与氧气反应的产物与反应条件无关 | |
| B. | 钠在反应中易失电子,表现出还原性 | |
| C. | 钠在氯气中燃烧产生红色火焰 | |
| D. | 钠只有在加热条件下才能与氯气发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com