
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是( )
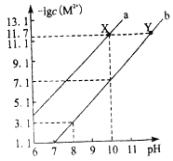
A.曲线b表示Cu(OH)2饱和溶液中的变化关系
B.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
D.向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
【答案】C
【解析】
A.根据图像, pH=10时,c(OH-)=10-4 molL-1,曲线b上对应的 -lgc(M2+)=7.1,c(M2+)=
10-7.1 molL-1,Ksp1=10-7.1×(10-4)2=10-15.1,曲线a上对应的 -lgc(M2+)=11.7,c(M2+)=10-11.7
molL-1,Ksp2=10-11.7×(10-4)2=10-19.7,Ksp1>Ksp2,故曲线a表示Cu(OH)2饱和溶液中的变化关系,曲线b表示Fe(OH)2饱和溶液中的变化关系
B.加入适量CuO调节pH,Cu2+先沉淀,B错误;
C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)= Ksp[Fe(OH)2:Ksp[Cu(OH)2]= 10-15.1:10-19.7=104.6∶1,C正确;
D.向X点对应的Cu(OH)2饱和溶液中加入少量NaOH固体,c(OH-)增大,Ksp[Cu(OH)2]不变,则c(Cu2+)变小,而Y点对应的溶液中c(Cu2+)与X点相同,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】利用核磁共振技术测定有机物分子的三维结构的研究曾获得诺贝尔化学奖。在有机物分子中,不同位置的氢原子的核磁共振氢谱中给出的峰值(信号)也不同。根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
例如:乙醚的结构式为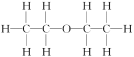 ,其核磁共振氢谱中有2个峰(信号)(参见下图)。
,其核磁共振氢谱中有2个峰(信号)(参见下图)。
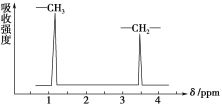
CH3CH2OCH2CH3的核磁共振氢谱
(1)下列分子中,其核磁共振氢谱中只有一种峰(信号)的物质是________。
A.CH3CH3 B.CH3COOH C.CH3COOCH3 D.CH3COCH3
(2)化合物A和B的分子式都是C2H4Br,A的核磁共振氢谱如图所示,则A的结构简式为________,请预测B的核磁共振氢谱上有________个峰(信号)。

A的核磁共振氢谱示意图
(3)用核磁共振氢谱的方法来研究C2H6O的结构,请简要说明根据核磁共振氢谱的结果来确定C2H6O分子结构的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究新制饱和氯水成分的实验时,由实验现象得出的结论错误的是
A.氯水呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl-
C.向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO
D.向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+![]() Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色。
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
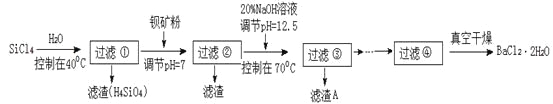
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解反应的化学方程式为_________________________________________________。过滤操作需要的玻璃仪器有_________________________________。
(2)加钡矿粉调节pH=7的作用是________________________、_______________________。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是_______________________。
(4)BaCl2滤液经__________、_________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(5)10吨含78.8 % BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_________吨。实际产量为9.70吨,相对误差为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 X中可能含有如下离子:Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
A.取溶液X进行焰色反应,火焰呈黄色。说明溶液不含K+
B.取固体Y加入过量的稀盐酸,沉淀部分溶解。说明溶液X含![]() 、不含
、不含![]()
C.取滤液Z加入足量HNO3后再加入AgNO3溶液,有白色沉淀生成。说明溶液X中含Cl-
D.取滤液Z加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。说明溶液X中含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述不正确的是
Z(g)+W(s) ΔH>0,下列叙述不正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率不变
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com