
已知:P4(g)+6Cl2(g)===4PCl3(g),
ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。
下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能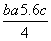 kJ·mol-1
kJ·mol-1
D.P—P键的键能为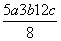 kJ·mol-1
kJ·mol-1
答案 C
解析 A项,由于氯原子半径小于磷原子半径,所以P—P键的键能应小于P—Cl键的键能,错误;
B项,由于不知PCl5(g)===PCl5(s)对应的ΔH,所以无法根据盖斯定律求得该反应的ΔH,错误;
C项,P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1①
P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1②
①-②得
Cl2(g)+PCl3(g)===PCl5(g) ΔH=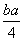 kJ·mol-1
kJ·mol-1
ECl-Cl+3×1.2c kJ·mol-1-5×c kJ·mol-1=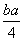 kJ·mol-1
kJ·mol-1
ECl-Cl=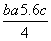 kJ·mol-1,正确;
kJ·mol-1,正确;
D项,根据P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1得
6EP-P+10×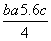 kJ·mol-1-4×5c kJ·mol-1=b kJ·mol-1
kJ·mol-1-4×5c kJ·mol-1=b kJ·mol-1
EP-P=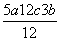 kJ·mol-1,错误。
kJ·mol-1,错误。


科目:高中化学 来源: 题型:
两个惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计),电极上析出银的质量最大为( )
A.27 mg B.54 mg C.106 mg D.216 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64 kJ·mol-1,当放出314.624 kJ热量时,SO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1
C.-191 kJ·mol-1 D.+191 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)[2013·新课标全国卷Ⅰ,28(3)]二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(ⅰ)CO(g)+2H2(g)===CH3OH(g)
ΔH1=-90.1 kJ·mol-1
(ⅱ)CO2(g)+3H2(g)===CH3OH(g)+H2O(g)
ΔH2=-49.0 kJ·mol-1
水煤气变换反应:(ⅲ)CO(g)+H2O(g)===CO2(g)+H2(g)
ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:(ⅳ)2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH4=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________。
(2)[2013·四川理综,11(5)节选]焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)??2SO3(g)
ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)
ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是________。
(3)[2013·浙江理综,27(1)]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)??(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)??NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)??2NH4HCO3(aq)ΔH3
ΔH3与ΔH1、ΔH2之间的关系是:ΔH3=________。
(4)[2013·天津理综,10(2)①]为减少SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)===H2O(g)
O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
C(s)+ O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:__________________________________________。
(5)[2013·北京理综,26(2)①]汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
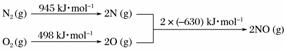
写出该反应的热化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
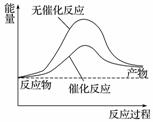
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1,则碳的燃烧热为110.5 kJ·mol-1
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应H2(g)+Cl2(g)===2HCl(g)
ΔH=-a kJ·mol-1,
Ⅱ: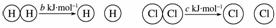
且a、b、c均大于零,则断开1 mol H—Cl键所需的能量为 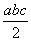 kJ
kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
求下列常温条件下溶液的pH(已知lg1.3=0.1,lg2=0.3,混合溶液忽略体积的变化)。
(1)0.005 mol·L-1的H2SO4溶液
(2)0.1 mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度= ×100%)
×100%)
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合
(6)将pH=3的HCl与pH=3的H2SO4等体积混合
(7)0.001 mol·L-1的NaOH溶液
(8)pH=2的盐酸与等体积的水混合
(9)pH=2的盐酸加水稀释到1 000倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com