
| A、把pH=6的盐酸稀释1000倍 |
| B、把pH=8的NaOH溶液稀释10倍 |
| C、把10mL 1×10-5mol/L的H2SO4溶液与10mL 4×10-5mol/L的NaOH溶液相混合 |
| D、把c(OH-)=10-5mol/L的NaOH溶液10mL加到100mL浓度为10-4mol/L的NaOH溶液中 |
| 4×10-5mol/L×10-2L-2×10-5mol/L×10-2L |
| 2×10-2L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0的反应均是自发反应 |
| B、自发进行的反应一定能迅速进行 |
| C、冰在室温下自动熔化成水,是熵增的重要结果 |
| D、高锰酸钾加热分解是一个熵减小的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是氧化剂 |
| B、是还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O+H2O=2NaOH |
| B、2F2+2H2O=4HF+O2 |
| C、3NO2+H2O=2HNO3+NO |
| D、2Na+2H2O=2NaOH+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它的核外电子排布式为1s22s22p63s23p4 |
| B、它的元素符号为O |
| C、它可与H2生成液态化合物 |
D、轨道表示式为: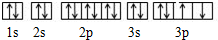 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com