
| A. | c(OH-)>c(H+) | B. | c(NH4+)>c(NH3•H2O) | ||
| C. | c(NH4+)>c(H+)=c(OH-)>c(Cl-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
分析 将物质的量相同的NH3•H2O和NH4Cl混合配成溶液,由于一水合氨的电离程度大于NH4+的水解程度,则混合液呈碱性:c(OH-)>c(H+)、c(NH4+)>c(NH3•H2O);溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),根据电荷守恒及c(OH-)>c(H+)可知:c(NH4+)>c(Cl-),据此进行解答.
解答 解:A.物质的量相同的NH3•H2O和NH4Cl混合配成溶液,由于一水合氨的电离程度大于NH4+的水解程度,则混合液呈碱性:c(OH-)>c(H+),故A正确;
B.一水合氨的电离程度大于NH4+的水解程度,则c(NH4+)>c(NH3•H2O),故B正确;
C.一水合氨的电离程度大于铵根离子的水解程度,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-),溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.混合液显示碱性,则c(OH-)>c(H+),根据电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-)可知,c(NH4+)>c(Cl-),则溶液中正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选CD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确“浓度相等时一水合氨的电离程度大于NH4+的水解程度,则混合液呈碱性”为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
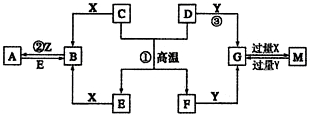
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,KW增大,pH不变 | |
| B. | 向水中加入少量NaHSO4固体,恢复到原温度,水的电离被抑制,C(H+) 增大 | |
| C. | 向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小 | |
| D. | 向水中加少量KOH固体,恢复到原温度,水的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol/(L•min) | B. | 0.6mol/(L•min) | C. | 0.9mol/(L•min) | D. | 1.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰可升华、液氨可汽化 | |
| B. | 干冰有酸性、液氨有碱性 | |
| C. | 干冰升华、液氨汽化时可放出大量热 | |
| D. | 干冰升华、液氨汽化时可吸收大量热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的摩尔质量为28 | |
| B. | 标准状况下,11.2 L四氯化碳所含分子数为0.5 NA | |
| C. | 1L 0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA | |
| D. | 16g CH4所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用pH试纸来测定1mol•L-1硫酸溶液的pH | |
| B. | NH3可以使湿润的pH试纸变红 | |
| C. | 用广泛pH试纸测定某氢氧化钠溶液的pH为12.5 | |
| D. | 用干燥洁净的玻璃棒蘸取待测液,滴到pH试纸上,再和标准比色卡对照 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com