
将a g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下的气体0.224 L。则下列判断中正确的是
A. 向溶液中滴入KSCN溶液,显血红色
B. 原混合物中n(Fe)∶n(Fe2O3)=2∶1
C. 无法计算原混合物的质量
D. 此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2016-2017学年辽宁省六校协作体高二下学期期初化学试卷 题型:选择题
可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是( )
A. 新制氢氧化铜悬浊液 B. 银氨溶液 C. 石蕊试液 D. 碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:填空题
按要求书写方程式:
(1)过氧化钠与CO2反应的化学方程式:__________________________________________
(2)镁条在二氧化碳中燃烧的化学方程式:________________________________________
(3)将少量硫酸铝溶液滴入足量NaOH溶液中的离子方程式:________________________
(4)铁与高温水蒸气反应的化学方程式:______________________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 1molO2在任何情况下都是32g B. 摩尔是一个基本物理量
C. H2SO4的摩尔质量是98g D. 1摩尔氢的质量是2g
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:填空题
Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题。
(1)工业上将氯气通入消石灰中制取漂白粉,写出该反应的化学方程式__________。
(2)漂白粉的有效成分是(填化学式)_________。
(3)氯水与二氧化硫均具有漂白性,若将两者按适当比例混合则漂白性很差,用离子方程式表示其原因____。
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里用0.1mol/LKMnO4溶液与300ml0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为________ml。(已知MnO4-在此条件下被还原为Mn2+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
向含有FeBr2和FeI2各0.4mol的混合稀溶液中,逐滴滴加稀氯水至过量,反应分三个阶段进行,各阶段消耗氯气的物质的量之比依次是
A. 2:1:1 B. 1:2:1 C. 2:1:2 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省石家庄市高一上学期期末考试化学试卷(解析版) 题型:选择题
用下图所示装置能达到有关实验目的是
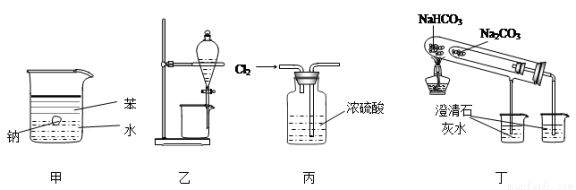
A. 用甲图装置证明密度ρ(苯)<ρ(钠)<ρ(水)
B. 用乙图装置分离酒精和四氯化碳
C. 用丙图装置干燥Cl2
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上学期期末考试化学试卷(解析版) 题型:简答题
Ⅰ、运用铁及其化合物的知识,完成下列各题。
(1)下列物质跟铁反应后的生成物,能跟KSCN溶液作用生成红色溶液的是________。
A.盐酸 B.氯气 C.CuSO4溶液 D.稀硫酸
(2)把过量的铁粉加入稀硝酸中,其结果是________。
A.不反应 B.生成硝酸铁 C.生成硝酸亚铁
(3)要除去FeCl2溶液中的少量FeCl3,可行的办法是________。
A.滴入KSCN溶液 B.通入氯气 C.加入铜粉 D.加入铁粉
Ⅱ、工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别。线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径。
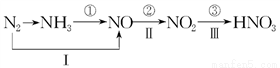
(1)写出①步反应的化学方程式:____________________________________________________。
(2)下列环境问题与NO2的排放有关的是________(填字母序号)。
A.赤潮 B.光化学烟雾 C.臭氧空洞 D.温室效应 E.酸雨
(3)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二下学期开学考试化学试卷(解析版) 题型:填空题
已知:I2+2S2O32-=S4O62-+2I-
相关物质的溶度积常数见下表:
物质 | Cu(OH)2蓝色 | Fe(OH)3红褐 | CuCl白色 | CuI白色 |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.02×10-6 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入___________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是__________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
可选用_________作滴定指示剂,滴定终点的现象是________________。
CuCl2溶液与KI反应的离子方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com