
(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是_______________________________________________________;
纯碱溶液呈碱性的原因是(用离子方程式表示)___________________________。
(2)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:
__________________________________________________________________。
(3)为证明盐的水解是吸热反应,四位学生分别设计了如下方案,其中正确的是
_____________。
A.甲学生:在醋酸钠溶液中滴入2滴酚酞溶液,加热后红色加深,说明盐类水解是吸热反应
B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应
C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
B项中和反应本身是放热反应,C项是因为NH4NO3溶于水吸热,D项是因为NH4Cl抑制NH3·H2O 的电离而使pH变小
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、硫酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因________________________________________________________________________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?________。若能,请写出电极反应式,负极:____________________,正极:________________________。(若不能,后两空不填)
(3)设计一种以铁和稀硫酸反应为原理的原电池,要求画出装置图(需标明电极材料及电池的正、负极)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,一定条件下,某密闭容器中的可逆反应R(s)+X(g) Y(g)+Z(g)ΔH>0,达到平衡态Ⅰ后,在t1时刻改变影响平衡的一个条件,平衡发生移动,达到平
Y(g)+Z(g)ΔH>0,达到平衡态Ⅰ后,在t1时刻改变影响平衡的一个条件,平衡发生移动,达到平 衡态Ⅱ。则t1时刻的条件改变可能是( )
衡态Ⅱ。则t1时刻的条件改变可能是( )
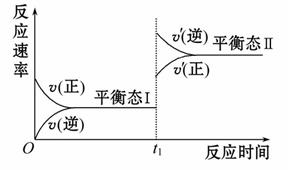
A.升高温度 B.减小体积
C.增大Y的浓度 D.加入一定量的R
查看答案和解析>>
科目:高中化学 来源: 题型:
在加入铝粉能产生H2的溶液中,下列各组离子可能大量共存的是( )
A.NH4+ NO3- CO32- Na+
B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Mg2+ K+ Cl-
D.NO3- K+ [Al(OH)4]- OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在pH=12的某溶液中,分别有甲、乙、丙、丁四位同学计算出由水电离出的[OH-]的数据分别为甲:1.0×10-7 mol· L-1;乙:1.0×
L-1;乙:1.0×
10-6 mol·L-1;丙:1.0×10-2 mol·L-1;丁:1.0×10-12 mol·L-1。其中你认为可能正确的数据是( )
A.甲、乙 B.乙、丙 C.丙、丁 D.乙、丁
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表短周期的一部分如图所示。下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
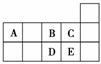
A.D在过量的B中燃烧的主要产物为DB3
B.C的氢化物的水溶液酸性比E的强
C.A与B形成的阴离子可能有AB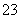 、A2B
、A2B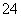
D.E单质中由于形成了氢键,所以很容易液化
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,原子序数依次增大。其中X、Z同主族,Y、Z同周期,Y原子的最外层电子数是次外层电子数的一半,X原子的最外层电子数是核外电子层数的3倍,W的最高正化合价与最低负化合价的代数之和为6。下列说法正确的是( )
A.X、Y、Z、W四种元素的简单氢化物中,W的氢化物的沸点最高
B.X、Y、Z三种元素的原子半径由大到小的顺序为Y>X>Z
C.Y、Z、W三种元素的非金属性由强到弱的顺序为W>Z>Y
D.Y、Z、W三种元素的最高价氧化物对应的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
① 1/4CaSO4(s)+CO(g)1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
② CaSO4(s)+CO(g)CaO(s)+CO2(g) +SO2(g)
ΔH2=+210.5 kJ·mol-1
③ CO(g)1/2C(s)+1/2CO2(g) ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)
(2)[2014·全国新课标Ⅰ,28(2)]已知:
甲醇脱水反应
2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应
2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应
C2H5OH(g)===CH3OCH3(g) ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。
(3)[2014·四川理综,11(3)]已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
区别浓硫酸与稀硫酸,既简单又可靠的方法是( )
|
| A. | 各取少许溶液分别放入铜片 |
|
| B. | 分别与石蕊溶液作用 |
|
| C. | 各取少许溶液加入BaCl2溶液 |
|
| D. | 各许少许溶液分别放入铁片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com