
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应在一定压强下,达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)=1.2mol | B.若为定压容器,n(NH3) >1.2mol |
| C.若为定容容器,n(NH3)>1.2mol | D.若为定压容器,n(NH3)<1.2mol |
科目:高中化学 来源: 题型:单选题
对于可逆反应N2(g)+3H2(g)  2NH3(g) ΔH<0,下列研究目的和示意图相符的是
2NH3(g) ΔH<0,下列研究目的和示意图相符的是
| | A | B | C | D |
| 研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
| 示意图 |  | 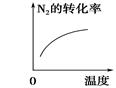 | 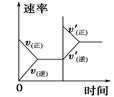 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在相同温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2 2NH3。
2NH3。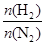 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )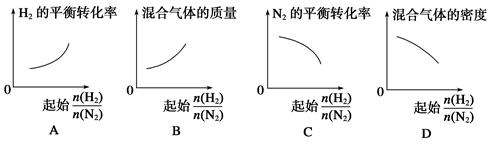
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
NO和CO都是汽车排放尾气中的有害物质,它们能缓慢地反应,生成N2和CO2,对此反应下列叙述正确的
| A.使用催化剂并不能改变反应速率 | B.使用催化剂可以加快反应速率 |
| C.降低压强能加快反应速率 | D.降温可以加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下可逆反应N2+3H2 2NH3已达到平衡,下列有关说法正确的 ( )
2NH3已达到平衡,下列有关说法正确的 ( )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H 键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成n molN2,同时生成2n molNH3
⑦气体的平均相对分子质量不再改变
⑧N2 H2 NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
| A.①②③④⑤⑥⑦⑨ | B.①②③⑤⑥⑩ |
| C.③④⑤⑥⑦⑧ | D.①②③⑤⑥⑦⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知①氨水溶液中存在平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。
NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。
。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于化学反应方向的确定,下列说法正确的
| A.反应的焓变是决定反应能否自发进行的唯一因素 |
| B.温度、压强一定时,放热反应能自发进行 |
| C.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| D.固体的溶解过程与焓变无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对已经达到化学平衡的2X(g)+Y(g) 2Z(g)减小压强时,对反应的影响是( )
2Z(g)减小压强时,对反应的影响是( )
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用平衡移动原理解释的是
| A.工业合成氨时使用催化剂 |
| B.配制FeCl3溶液时加入少量的盐酸 |
| C.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |
| D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com