
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是
A.c(NH4+):③ > ②
B.pH:① > ② > ③
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动
Mg2+ (aq) + 2OH- (aq)向溶解方向移动
D. 将等体积的①和③混合,所得溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-)
D
【解析】
试题分析:A、氢氧化镁能溶于NH4Cl溶液和醋酸铵溶液分别得到NH3·H2O、MgCl2混合溶液,NH3·H2O、(CH3COO)2Mg混合溶液,在后一种溶液中醋酸根离子水解呈碱性抑制NH3·H2O电离,故铵根离子浓度②>③,错误;B、氢氧化镁能溶于盐酸生成MgCl2溶液,显然碱性③最大①最小,错误;C、由③可以得出溶液为中性也能溶解氢氧化镁,所以应该是氢氧化镁电离出氢氧根子与铵根离子反应,促进平衡正向移动,错误;D、等体积①③混合得到等浓度的CH3COOH和NH4Cl混合溶液,根据③知CH3COO-和NH4+水解程度相同,则混合液中以醋酸的电离为主,故有上述关系,正确。
考点:考查溶液中微粒的关系有关问题。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:阅读理解
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)X和Y的名称依次是_________________、_________________。
(2)在镁粉作催化剂的条件下,用甲醇和二氧化碳在高压釜中合成碳酸二甲酯的化学方程式是___________________________________________________。
(3)M俗称石炭酸。M与水混合,液体呈浑浊,加入NaOH溶液后,试管中液体由浑浊变为澄清透明,向所得澄清溶液中通入二氧化碳,澄清溶液又变浑浊。上述变化的化学方程式是__________________________________、__________________________________。
(4)有机物B主要用于制造有机溶剂、香料和驱虫剂。B的一种合成方法为:
![]()
已知有机物B、D、E互为同分异构体。D在空气中可被氧化成有机物Z,Z能够与新制的银氨溶液发生银镜反应;E分子烃基上的氢若被Cl取代,其一氯代物只有三种。
D、E的结构简式分别是_____________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸二甲酯(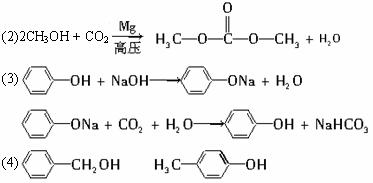 )常用来代替剧毒的光气(COCl2)等物质。镁粉作催化剂的条件下,用甲醇和二氧化碳在高压釜中可合成碳酸二甲酯。该方法的副反应生成有机物C2H4O2。C2H4O2难溶于水,但在酸性条件下可反应得到X和Y。X有毒,人饮用10 mL就能使眼睛失明。
)常用来代替剧毒的光气(COCl2)等物质。镁粉作催化剂的条件下,用甲醇和二氧化碳在高压釜中可合成碳酸二甲酯。该方法的副反应生成有机物C2H4O2。C2H4O2难溶于水,但在酸性条件下可反应得到X和Y。X有毒,人饮用10 mL就能使眼睛失明。
(1)X和Y的名称依次是 、 。?
(2)在镁粉作催化剂的条件下,用甲醇和二氧化碳在高压釜中合成碳酸二甲酯的化学方程式是 。
(3)M俗称石炭酸。M与水混合,液体呈浑浊,加入NaOH溶液后,试管中液体由浑浊变为澄清透明,向所得澄清溶液中通入二氧化碳,澄清溶液又变浑浊。上述变化的化学方程式是 。?
(4)有机物B主要用于制造有机溶剂、香料和驱虫剂。B的一种合成方法为:?
? ?
?
已知有机物B、D、E互为同分异构体。D在空气中可被氧化成有机物Z,Z能够与新制的银氨溶液发生银镜反应;E分子烃基上的氢若被Cl取代,其一氯代物只有三种。?
D、E的结构简式分别是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com