
【题目】硫元素形成的化合物有着广泛的用途。 请回答下列问题:
(1) 过二硫酸及其盐在工业上常用作强氧化剂。
①过二硫酸的结构为 ,其中氧元素的化合价为________。
,其中氧元素的化合价为________。
②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色。该反应的离子方程式为______。
③电解法是制备过二硫酸钾的方法之一, 其装置示意图如下:

则:b 为电源的______极; 阳极反应式为_________________; 导线中流过 1 mol 电子时, 理论上通过阳离子交换膜的K+的数目为___________。
(2)Na2SO4是重要的工业原料,检验其溶液中含有SO42-的操作及现象为______________。
【答案】 -2 价和-1 价 5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+ 负 2SO42--2e-=S2O82- NA或 6.02×1023 取待测液少量于洁净试管中,加入足量稀盐酸无明显现象, 再加 BaCl2溶液产生白色沉淀,则溶液中含有 SO42-
【解析】(1)①过二硫酸的结构为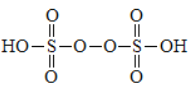 ,其中过氧键氧元素的化合价为-1价,其余氧元素的化合价是-2价。②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色,说明锰离子被氧化为高锰酸根离子,因此根据电子得失守恒和原子守恒可知该反应的离子方程式为5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+。③硫酸根在阳极失去电子转化为过二硫酸钾,阴极是溶液中的氢离子得到电子转化为氢气,即A是氢气,所以b 为电源的负极,阳极反应式为2SO42--2e-=S2O82-;导线中流过1 mol电子时,根据电荷守恒可知理论上通过阳离子交换膜的K+的数目为NA或 6.02×1023。(2)检验其溶液中含有SO42-的操作及现象为:取待测液少量于洁净试管中,加入足量稀盐酸无明显现象,再加 BaCl2溶液产生白色沉淀,则溶液中含有 SO42-。
,其中过氧键氧元素的化合价为-1价,其余氧元素的化合价是-2价。②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色,说明锰离子被氧化为高锰酸根离子,因此根据电子得失守恒和原子守恒可知该反应的离子方程式为5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+。③硫酸根在阳极失去电子转化为过二硫酸钾,阴极是溶液中的氢离子得到电子转化为氢气,即A是氢气,所以b 为电源的负极,阳极反应式为2SO42--2e-=S2O82-;导线中流过1 mol电子时,根据电荷守恒可知理论上通过阳离子交换膜的K+的数目为NA或 6.02×1023。(2)检验其溶液中含有SO42-的操作及现象为:取待测液少量于洁净试管中,加入足量稀盐酸无明显现象,再加 BaCl2溶液产生白色沉淀,则溶液中含有 SO42-。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】在无色溶液中,下列离子能大量共存的是( )
A.Mg2+、SO42-、K+、Cl-B.Na+、NH4+、NO3-、MnO4-
C.K+、Cu2+、Cl-、Br-D.Ba2+、Na+、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能获得成功的是
①用甲烷气体通入碘水制碘甲烷
②甲烷和溴蒸气混合光照制取纯净的一溴甲烷
③用洒精灯加热甲烷气体制取炭黑和氢气
A. 只有① B. 只有③ C. 只有② D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制0.1mol/L的NaOH溶液500mL,请回答:
(1)计算需要NaOH固体质量_________g。
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平 ⑦量筒。配制时,必须使用的玻璃仪器_____(填序号),还缺少的仪器是_____________。
(3)使用容量瓶前必须进行的一步操作是______________________。
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为___(填序号)。
① 洗涤 ② 定容 ③ 颠倒摇匀 ④ 转移
(5)配制过程中,下列操作会引起结果偏高的是_______(填序号)
①未洗涤烧杯、玻璃棒 ②称量NaOH的时间太长 ③定容时俯视刻度 ④容量瓶不干燥,含有少量蒸馏水 ⑤NaOH溶液未冷却至室温就转移到容量瓶
(6)现将200mL0.01mol/LNaOH与50mL0.02mol/LBa(OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH-的物质的量浓度是__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 硫酸氢钠溶液中加入氢氧化钡溶液至溶液呈中性:2H++SO42++Ba2++2OH-=BaSO4↓+2H2O
B. 澄清石灰水与过量碳酸氢钠溶液反应: HCO3-+Ca2++OH-=CaCO3↓+H2O
C. 金属钠和水发生反应: Na+H2O=Na++OH-+H2↑
D. 向AlCl3溶液中加入过量的氨水溶液: Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到实验目的是

A. 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B. 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C. 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤
D. 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将可逆反应:2NO2![]() 2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
2NO+O2在固定容积的密闭容器中进行,达到平衡的标志是
①单位时间内消耗n mol O2的同时,生成2n mol NO2
②单位时间内生成n mol O2的同时,消耗2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】已知化合物A能使紫色石蕊试液变红,化合物F合成路线如下:
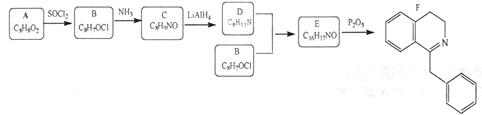
已知:![]()
(1)B→C的反应类型是_______________。
(2)下列说法不正确的是____________________。
A.化合物A含有羧基 B.化合物B能使酸性高锰酸钾溶液褪色
C.化合物D能与盐酸反应 D.化合物E具有联苯结构
(3)写出E→F的化学反应方程式_____________。
(4)已知:
①![]() ②
②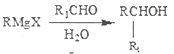 ③
③ ![]()
设计以氯苯和简单有机物(不超过两个碳原子)为原料制备A的合成路线(用流程图表示,无机试剂任选)___________。
(5)写出同时符合下列条件的E的同分异构体的结构简式(任写出两种)________________。
①分子中有两个苯环②![]() H-NMR谱表明分子中有5种氢原子③能发生银镜反应
H-NMR谱表明分子中有5种氢原子③能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com