
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B.b点对应的溶液中:K+、Ca2+、MnO4-、Cl-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
【答案】C
【解析】
试题分析:向Na2CO3、NaHCO3,a点溶液中含有CO32-和HCO3-,b点全部为HCO3-,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性,A.a点溶液中含有CO32-和HCO3-,HCO3-与OH-反应不能大量共存,故A错误;B.b点全部为HCO3-,MnO4-与Cl-发生氧化还原反应反应而不能大量共存,故B错误;C.c点恰好完全反应生成NaCl,溶液呈中性,离子之间不发生任何反应,可大量共存,故C正确;D.d点呈酸性,酸性条件下,NO3-与Fe2+发生氧化还原反应而不能大量共存,F-在酸性条件下不能大量共存,故D错误.故选:C.


科目:高中化学 来源: 题型:
【题目】氧元素有三种同位素,18O是氧的一种核素,下列说法正确的是
A. 18O原子所含质子数为18
B. 1mol 的1H218O分子所含中子数约为12NA个
C. 3.6g 的18O2气体的体积约为2.24 L
D. 18O2气体的摩尔质量为36 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示:盐碱地产生碱性的原因:__________________________________________;
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________n (填“>”“<”或“=”)。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(5)已知:常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;则 NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
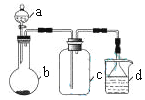
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液反应的热化学方程式为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,向1L0.5mol·L-1的NaOH溶液中加入下列物质:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,三者的关系正确的是( )
A.ΔH1>ΔH2>ΔH3B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2D.ΔH1>ΔH3>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g) +B(g)![]() 2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g)△H<0,反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内正反应的平均反应速率为: ;
(2)反应前A的物质的量浓度是: ;
(3)10s末,生成物D的浓度为 ;
(4)平衡后,若改变下列条件,生成D的速率如何变化(用“增大”、“减小”或 “不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | |
② | 增大A的浓度 | |
③ | 使用催化剂 | |
④ | 恒容下冲入Ne(不参与体系反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某绿色农药结构简式为,回答下列问题。

(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)__________________(用元素符号回答,下同),基态硒原子的价层电子排布式为________________________。
(2)该物质中杂化轨道类型为sp2的原子有__________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。与CH4互为等电子体的一种微粒是______。
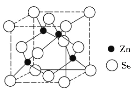
(4)硒化锌的晶胞结构如图所示,则硒的配位数为_______,若晶胞边长为d pm,设阿伏加德罗常数的值为NA,则硒化锌的密度为____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法不正确的是
出发合成BHT的方法有如下两种。下列说法不正确的是
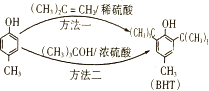
A. 推测BHT微溶或难溶于水
B. BHT与![]() 都能与溴水反应产生白色沉淀
都能与溴水反应产生白色沉淀
C. 方法一和方法二的反应类型分别是加成反应和取代反应
D. BHT与![]() 具有的官能团的种类和个数均相等
具有的官能团的种类和个数均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按照要求将相应序号填入空白中:
①![]() ②金刚石 ③CO ④CO2 ⑤37Cl ⑥
②金刚石 ③CO ④CO2 ⑤37Cl ⑥![]() ⑦SO2 ⑧
⑦SO2 ⑧![]() ⑨石墨 ⑩C60
⑨石墨 ⑩C60
(1)_______________互为同位素
(2)________________为酸性氧化物
(3)________________的质量数相等,但不能互为同位素
(4)________________互称同素异形体
Ⅱ.已知微粒间的相互作用有以下几种:
①离子键 ②极性共价键 ③非极性共价键 ④氢键 ⑤分子间作用力(范德华力)
下面是某同学对一些变化过程破坏的微粒间的相互作用的判断:
A.干冰熔化②⑤
B.氢氧化钠溶于水①
C.氯化氢气体溶于水②④
D.冰熔化④⑤
E.Na2O2溶于水①②
其中判断正确选项的是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com