
| A. | 过滤时将液体沿着玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| B. | 蒸馏时烧瓶需要垫石棉网 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 冷凝管的进水方向是低进高出 |
分析 A.过滤时液面应低于滤纸的边缘;
B.烧瓶不能直接加热;
C.蒸发时不能蒸干,利用余热加热;
D.冷水下进上出,在冷凝管中的停留时间长.
解答 解:A.过滤时将液体沿着玻璃棒注入过滤器,并使液面低于滤纸边缘,故A错误;
B.烧瓶不能直接加热,则蒸馏时烧瓶需要垫石棉网,故B正确;
C.蒸发时不能蒸干,利用余热加热,则当蒸发到剩余少量液体时,停止加热,故C正确;
D.冷水下进上出,在冷凝管中的停留时间长,则冷凝管的进水方向是低进高出,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法及实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
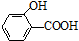 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 ( 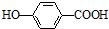 )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )| A. | 前者>后者 | B. | 前者<后者 | C. | 前者=后者 | D. | 无法估计 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
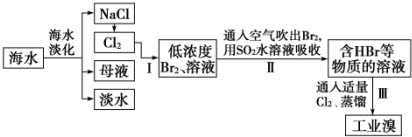
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +6 | B. | +3 | C. | +2 | D. | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
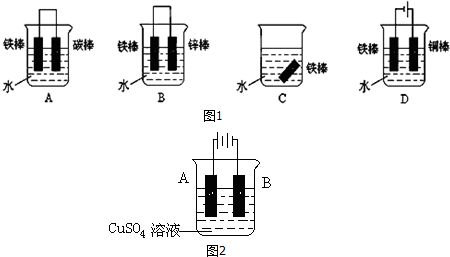
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K 37ClO3与浓盐酸(HCl)在加热下生成氯气的化学方程式:K 37ClO3+6HCl═K 37Cl+3Cl2↑+3H2O | |
| B. | 表示氢气燃烧热的热化学方程式:H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8 kJ/mol | |
| C. | 将1~2 mL氯化铁饱和溶液逐滴加到20 mL 沸水中所发生反应的离子方程式:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe (OH)3(胶体)+3H+ | |
| D. | 在氢氧化钡溶液中滴入硫酸氢钠溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com