
| A. | 标准状态时,22.4L的CO2 | B. | 200g49%的H3PO4 | ||
| C. | 32g 的SO2气体 | D. | 3.01×1023个O2分子 |
分析 根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合物质的构成计算.
解答 解:A.n(CO2)=$\frac{22.4L}{22.4L/mol}$=1mol,含有2molO原子;
B.n(H3PO4)=$\frac{200g×49%}{98g/mol}$=1mol,含有4molO原子;
C.n(SO2)=$\frac{32g}{64g/mol}$=0.5mol,含有1molO原子;
D.n(O2)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,含有1molO原子,
则含氧原子最多的为B.
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的构成特点以及相关计算公式的运用,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol,
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1 mol•L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3•H2O) | |
| B. | 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO${\;}_{3}^{2-}$)<c(HCO${\;}_{3}^{-}$) | |
| C. | 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-) | |
| D. | Na2CO3溶液中:2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | R | W | X | Y | Z | 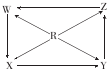 |
| A | Si | SiO2 | H2SiO2 | Na2SiO2 | SiCl4 | |
| B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
| C | Fe | Fe(OH)2 | FeCl3 | FeCl3 | Fe(NO4)3 | |
| D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO4)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2++SO42-═BaSO4↓ | |
| B. | 2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| C. | Al3++2SO42-+2Ba2++3OH-═2BaSO4↓+Al(OH)3↓ | |
| D. | Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com