
| A. | 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 氮化硅陶瓷是一种新型无机非金属材料 |
分析 A、采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体氮气和CO2;
B、氮氧化物能引起酸雨、光化学烟雾、破坏臭氧层;
C、利用太阳能等清洁能源代替化石燃料,有利于节约资源、同时保护环境;
D、氮化硅的化学式为Si3N4.
解答 解:A、采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体氮气和CO2:2xCO+2NOx$\frac{\underline{\;催化剂\;}}{\;}$2XCO2+N2,故A正确;
B、“酸雨“、“臭氧层受损“、“光化学烟雾“都与氮氧化物有关,故B错误;
C、太阳能等清洁能源代替化石燃料,有利于减少污染物的排放,节约资源,保护环境,故C正确;
D、氮化硅陶瓷是一种新型无机非金属材料,为原子晶体,沸点高、硬度大,其化学式为Si3N4,故D正确.
故选B.
点评 本题主要考查了常见的污染与防治,资源的使用等,难度不大,注意基础的积累.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
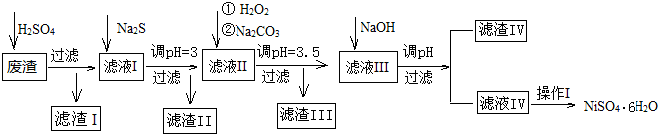
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液 | B. | NH4HCO3溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
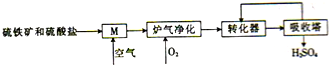 煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.
煤是重要的化工原料,煤的脱硫可减少环境的污染,利用煤矸石中的硫铁矿(主要成分为FeS2)和烟道脱硫得到的硫酸盐生产硫酸的工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的热稳定性:Z>W | B. | 最高价氧化物的水化物的酸性:X<Z | ||
| C. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | D. | 沸点:XW2>Y2W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com