
| æŖŹ¼³ĮµķŹ± | ³ĮµķĶźČ«Ź± | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c£ØOH-£©=1.8mol/L |
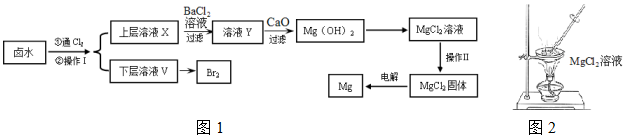
·ÖĪö ŹµŃéŹŅŅŌŗ¬ÓŠCa2+”¢Mg2+”¢Cl-”¢SO42-”¢Br-µČĄė×ÓµÄĀ±Ė®ĪŖÖ÷ŅŖŌĮĻÖʱøMgŗĶBr2£¬Ó¦½«»ģŗĻĪļÖŠCa2+”¢Cl-”¢SO42-µČĄė×Ó³żČ„£¬øł¾ŻĮ÷³ĢæÉŅŌ擳ö·Ö±š¼ÓČėĀČĘų½«ČÜŅŗÖŠµÄBr-Ńõ»Æäåµ„ÖŹ£¬¼ÓČėĖÄĀČ»ÆĢ¼ŻĶČ”·ÖŅŗ£¬µĆµ½ĻĀ²ćĪŖäåµÄĖÄĀČ»ÆĢ¼ČÜŅŗ£¬ŌŁÕōĮóµĆµ½äåµ„ÖŹ£»
ÉĻ²ćČÜŅŗ¼ÓČėĀČ»Æ±µ³żČ„SO42-£¬ÓĆCaOµ÷½ŚČÜŅŗYµÄpH£¬æÉŅŌµĆµ½Mg2+Ąė×ӵijĮµķĒāŃõ»ÆĆ¾£¬¼ÓČėŃĪĖįČܽāĒāŃõ»ÆĆ¾µĆµ½ĀČ»ÆĆ¾ČÜŅŗ£¬¾¹ż²Ł×÷¢ņµĆµ½ĀČ»ÆĆ¾¹ĢĢ壬µē½āČŪČŚĀČ»ÆĆ¾µĆµ½½šŹōĆ¾£¬¾Ż“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗ£Ø1£©ĀČĘų¾ßÓŠĒæŃõ»ÆŠŌ£¬ĶØČėĀČĘųŗóæÉŅŌ½«ČÜŅŗÖŠµÄBr-Ńõ»Æäåµ„ÖŹ£¬ŅņĪŖµ„ÖŹä弫Ņ×ČÜÓŚÓŠ»śČܼĮ£¬ĖłŅŌæÉŅŌ²ÉÓĆŻĶČ”µÄ·½·Ø£¬ŻĶČ”µÄÖ÷ŅŖŅĒĘ÷ŹĒ·ÖŅŗĀ©¶·”¢ÉÕ±£¬ŅņĪŖŻĶČ”ŗóµĆµ½ĻĀ²ćĪŖäåµÄÓŠ»śČÜŅŗ£¬ŌņŻĶČ”¼ĮĪŖĆܶȓóÓŚĖ®µÄĖÄĀČ»ÆĢ¼£»
¹Ź“š°øĪŖ£ŗŻĶČ”·ÖŅŗ£»·ÖŅŗĀ©¶·”¢ÉÕ±£»c£»
£Ø2£©øł¾ŻŅŌÉĻ·ÖĪö£¬ĶØĀČĘų½«ČÜŅŗÖŠµÄBr-Ńõ»Æäåµ„ÖŹ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCl2+2Br-=2Cl-+Br2£¬¹Ź“š°øĪŖ£ŗCl2+2Br-=2Cl-+Br2£»
£Ø3£©ÉĻ²ćČÜŅŗ¼ÓČėĀČ»Æ±µ³żČ„SO42-£¬ŌņÖ¤Ć÷SO42-ĶźČ«³ĮµķµÄ·½·ØŹĒ¾²ÖĆĻņÉĻ²ćĒåŅŗÖŠ¼ĢŠų¼ÓČėBaCl2ČÜŅŗ£¬Čō²»²śÉś°×É«³ĮµķŌņÖ¤Ć÷SO42-ŅŃ³ĮµķĶźČ«£¬¹Ź“š°øĪŖ£ŗ¾²ÖĆĻņÉĻ²ćĒåŅŗÖŠ¼ĢŠų¼ÓČėBaCl2ČÜŅŗ£¬Čō²»²śÉś°×É«³ĮµķŌņÖ¤Ć÷SO42-ŅŃ³ĮµķĶźČ«£»
£Ø4£©ÓɱķÖŠŹż¾ŻæÉÖŖpH“óÓŚ11Ź±Mg2+³ĮµķĶźČ«£¬pH“óÓŚ12.2Ź±£¬Ca2+æŖŹ¼³Įµķ£¬ĖłŅŌĄķĀŪÉĻæÉŃ”ŌńpH×ī“ó·¶Ī§ŹĒ11.0£¼pH£¼12.2£»
¹Ź“š°øĪŖ£ŗ11.0£¼pH£¼12.2£»
£Ø5£©ĀČ»ÆĆ¾ČÜŅŗ¾¹ż²Ł×÷¢ņµĆµ½ĀČ»ÆĆ¾¹ĢĢ壬ŅņĪŖĀČ»ÆĆ¾ČÜŅŗŌŚ¼ÓČČŹ±Ņ×·¢ÉśĖ®½ā£¬ĖłŅŌ²»ÄÜÖ±½ÓÕō·¢½į¾§£¬ŌņŠčŅŖŌŚĀČ»ÆĒāµÄĘųĮ÷ÖŠÕōøÉ£¬¹Ź“š°øĪŖ£ŗ²»ÄÜ£»MgCl2+2H2O?Mg£ØOH£©2+2HCl£»
£Ø6£©µē½āĀČ»ÆĆ¾ČÜŅŗµÄĄė×Ó·“Ó¦ĪŖ£ŗMg2++2H2O+2Cl-$\frac{\underline{\;Ķصē\;}}{\;}$Mg£ØOH£©2”ż+H2”ü+Cl2”ü£¬µĆ²»µ½Ć¾µ„ÖŹ£¬¹Ź“š°øĪŖ£ŗMg2++2H2O+2Cl-$\frac{\underline{\;Ķصē\;}}{\;}$Mg£ØOH£©2”ż+H2”ü+Cl2”ü£»
£Ø7£©Mg£ØOH£©2×ĒŅŗ“ęŌŚČܽāĘ½ŗāMg£ØOH£©2£Øs£©?Mg2+£Øaq£©+2OH-£Øaq£©£¬¼ÓČėŹŹĮæNH4Cl¾§Ģ壬NH4ClµēĄė³öµÄNH4+ÓėOH?½įŗĻ³ÉČõµē½āÖŹŅ»Ė®ŗĻ°±£¬½µµĶĮĖc£ØOH-£©£¬Mg£ØOH£©2ČܽāĘ½ŗāĻņÓŅŅĘ¶Æ£¬ĖłŅŌMg£ØOH£©2×ĒŅŗ³ä·ÖÕńµ“ŗó×ĒŅŗ»į±ä³ĪĒ壻
¹Ź“š°øĪŖ£ŗMg£ØOH£©2£Øs£©?Mg2+£Øaq£©+2OH-£Øaq£©£¬NH4ClµēĄė³öµÄNH4+ÓėOH?½įŗĻ³ÉČõµē½āÖŹŅ»Ė®ŗĻ°±£¬½µµĶĮĖc£ØOH-£©£¬Mg£ØOH£©2ČܽāĘ½ŗāĻņÓŅŅĘ¶Æ£®
µćĘĄ ±¾ĢāÖ÷ŅŖ漲鳣¼ūµÄ»ł±¾ŹµŃé²Ł×÷”¢ŅĒĘ÷µÄŹ¹ÓĆŗĶŹµŃé·½°øÉč¼Ę£¬×ŪŗĻŠŌĒ棬ÄѶČÖŠµČ£¬½ØŅéѧɜ¶ąÖŲŹÓ»ł“”ÖŖŹ¶µÄѧĻ°£¬×ÅĮ¦Ģįøß·ÖĪöĪŹĢā”¢½ā¾öĪŹĢāµÄÄÜĮ¦£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČÓŚ20% | B£® | “óÓŚ20% | C£® | Š”ÓŚ20% | D£® | ĪŽ·Ø¼ĘĖć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 500mLČÜŅŗÖŠĖłŗ¬K+”¢SO42-×ÜŹżĪŖ0.3NA | |
| B£® | 500mLČÜŅŗÖŠŗ¬ÓŠ0.1NAøöK+ | |
| C£® | 1LČÜŅŗÖŠK+ÅضČĪŖ0.2 mol/L | |
| D£® | 1LČÜŅŗÖŠSO42-µÄÅضČĪŖ0.4 mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | æĻ¶Ø²»ŗ¬I- | B£® | æÉÄܲ»ŗ¬Cu2+ | C£® | æÉÄÜŗ¬ÓŠSO32- | D£® | ŅŌÉĻ½įĀŪ¶¼²»¶Ō |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øÖĢśĪüŃõøÆŹ“¹ż³ĢÖŠÕż¼«·“Ó¦ĪŖ2H++2e-ØTH2”ü | |
| B£® | ¶čŠŌµē¼«µē½āČŪČŚNaClŹ±Ņõ¼«”¢Ńō¼«²śÉśĘųĢåĢå»ż±ČĪŖ1£ŗ1 | |
| C£® | H2ŌŚ·“Ó¦Li2NH+H2ØTLiNH2+LiHÖŠ¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į | |
| D£® | ÓĆĢś×öµē¼«µē½āCuCl2ČÜŅŗµÄĄė×Ó·½³ĢŹ½ĪŖCu2++2Cl-$\frac{\underline{\;µē½ā\;}}{\;}$Cu+Cl2”ü |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com