
| 实验目的 | 操作 | |
| A | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| A. | A | B. | B | C. | C | D. | D |
分析 A.醛基和碳碳双键都能使酸性高锰酸钾溶液氧化;
B.溴能和苯酚发生取代反应,能被苯萃取;
C.发生氧化还原反应;
D.盐溶液水解程度越大,对应酸的酸性越弱.
解答 解:A.双键和醛基都能使高锰酸钾溶液褪色,欲证明CH2=CHCHO中含有碳碳双键需要先用新制氢氧化铜氧化醛基后再通入高锰酸钾溶液或溴水褪色证明,故A错误;
B.向混合液中加入浓溴水,充分反应后,苯酚反应,同时溴单质易溶于苯中,引入新的杂质,故B错误;
C.SO2使KMnO4酸性溶液褪色是因为SO2的还原性,故C错误;
D.盐溶液水解程度越大,对应酸的酸性越弱;测同温同浓度Na2CO3和Na2SiO3水溶液的pH,碳酸钠溶液PH小于硅酸钠溶液,说明硅酸酸性小于碳酸,证明碳非金属性大于硅,故D正确.
故选D.
点评 本题考查了实验方案设计的评价,明确实验原理是解本题关键,根据物质的性质来分析解答,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
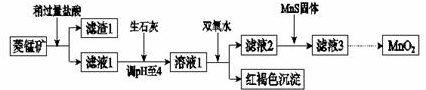
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a>2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O | |
| B. | 当a<b时,发生的离子反应为:OH-+CO2=HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2=CO32-+HCO3-+H2O | |
| D. | 当0.5a<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
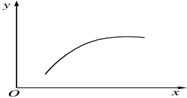 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)?2C(g)△H<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合图中曲线的是( )| 选项 | x | y |
| A | 温度 | 混合气体的平均相对分子质量 |
| B | 压强 | A的百分含量 |
| C | 再通入A | B的转化率 |
| D | 加入催化剂 | A的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||
| B. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,离子方程式为:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | ||||||
| D. | 碳酸和次氯酸的电离平衡常数见表,二氧化碳通入次氯酸钠溶液中:2NaClO+CO2+H2O═Na2CO3+2HClO
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ | B. | $\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ | ||
| C. | $\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ | D. | c(H+)•c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2gD2O与2gH218O含有的中子数均为NA | |
| B. | 1L0.1mol•L-1Na2S溶液中S2-和H2S的数目之和为0.1NA | |
| C. | 漂白粉中加入浓盐酸,每生成1molCl2,转移的电子数2NA | |
| D. | 常温下,将1molNO2气体加压生成N2O4的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中少量SO2气体,可将气体通过饱和碳酸氢钠溶液洗气 | |
| B. | 除去乙醇中含有的少量水,可加入生石灰,然后进行蒸馏 | |
| C. | 滴定管使用前需要检漏,装溶液时需要润洗 | |
| D. | 除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液除去乙酸,再进行蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com