
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
分析 根据n=$\frac{V}{Vm}$计算混合气体的物质的量,根据体积比较计算甲烷、氢气的物质的量,再根据热化学方程式计算燃烧放出的热量,注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算.
解答 解:标准状况下,112L甲烷和氢气混合气体的物质的量为$\frac{112L}{22.4L/mol}$=5mol,甲烷和氢气的体积之比为4:1,所以甲烷的物质的量为:5mol×$\frac{4}{5}$=4mol,氢气的物质的量为5mol-4mol=1mol,
由①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-Q1;
②2H2(g)+O2(g)=2H2O(g)△H=-Q2
③H2O(g)=H2O(l)△H=-Q3
根据盖斯定律①+③×2可得,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-(Q1+2Q3),
根据盖斯定律②+③×2可得,2H2(g)+O2(g)=2H2O(l)△H=-(Q2+2Q3),
4mol甲烷燃烧放出的热量为4×(Q1+2Q3)kJ,1mol氢气燃烧放出的热量为1×0.5×(Q2+2Q3),
所以放出的热量为4×(Q1+2Q3)+1×0.5×(Q2+2Q3)=4Q1+0.5Q2+9Q3kJ,
故选:D.
点评 本题考查根据热化学方程式计算反应热,难度不大,注意根据水的状态选择相应的热化学方程式计算反应热.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
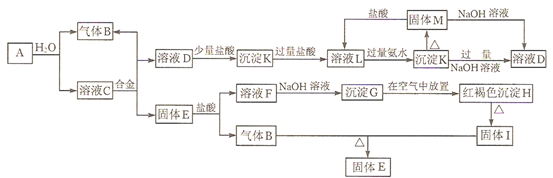
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极为锌 | |
| B. | 电池正极反应式为:MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 该电池反应中二氧化锰起催化剂作用 | |
| D. | 当 0.l mol Zn 完全溶解时,流经电解液的电子数目为 1.204×l023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ④⑥⑦ | C. | ②③⑤ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中不可能含有离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | 2NaOH+Cl2=NaCl+NaClO+H2O | D. | NH3+CO2+H2O=NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com