
【题目】能正确表示下列反应的离子方程式是( )
A. Na2S水解:S2- +2H2O H2S+2OH﹣
B. 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+ = 2Fe(OH)3+3Mg2+
C. 用醋酸溶液除水垢:2H++ CaCO3=Ca2++ H2O+CO2↑
D. 用铜为电极电解饱和食盐水:2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
【答案】B
【解析】A.硫离子的水解分步进行,以第一步为主;B.氢氧化铁更难溶;C.醋酸为弱酸;D.铜为活性电极,作阳极时铜放电生成铜离子;据此分析判断。
A.Na2S水解分步进行,以第一步水解为主,正确的离子方程式为:S2-+H2OHS-+OH-,故A错误;B.向FeCl3溶液中加入Mg(OH)2,反应的离子方程式为:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+,故B正确;C.醋酸为弱酸,用醋酸溶液除水垢,离子方程式:2CH3COOH+CaCO3=Ca2++H2O+CO2↑+2CH3COO-,故C错误;D.以铜为电极电解饱和食盐水,铜为活性电极,作阳极时铜放电生成铜离子,阴极生成氢气和氢氧根离子,铜离子与氢氧根离子反应生成氢氧化铜,正确的离子方程式为:Cu+2H2O![]() H2↑+Cu(OH)2↓,故D错误;故选B。
H2↑+Cu(OH)2↓,故D错误;故选B。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: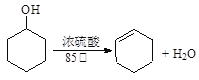 ;
;
反应物和生成物的物理性质如下表:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
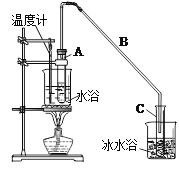
制备粗品:将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入
饱和食盐水,振荡、静置、分层,环己烯在 层(填上
或下),分液后用 (填序号)洗涤:
a.KMnO4溶液 b.稀H2SO4c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从 (填字母)口进入;蒸馏时要加入生石灰的目的 。
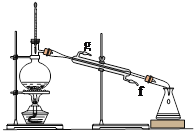
③上图蒸馏装置收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 :a.蒸馏时从70℃开始收集产品;b.环己醇实际用量多了;c.制备粗品时环己醇随产品一起蒸出;d.是可逆反应,反应物不能全部转化
(3)区分环己烯精品和粗品(是否含有反应物)的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L水中含有的氢原子数为NA
B. 1 mol·L-1FeCl3溶液中,阳离子数为NA
C. 一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数为NA
D. 在反应2Na2O2+2CO2![]() 2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA
2Na2CO3+O2中,每生成0.5 molO2转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层有2个电子的元素一定是第ⅡA族元素
B.原子外层有3个电子的元素一定是第ⅢA族元素
C.在化合物中显-1价的元素一定位于第ⅦA族
D.核外有3个电子层的离子对应的元素一定位于第三周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe棒和Cu棒用导线连接,放入某电解质溶液中,构成如图所示装置。试回答下列问题:

(1)若电解质溶液为硫酸溶液,则Cu棒上发生的电极反应为_________________。
(2)若电解质溶液为硫酸铜溶液,则Cu棒上的现象为____________________。
(3)若电解质溶液为氯化钠溶液,且在Cu棒附近不断通入氧气,则Cu棒上的电极反应为________________。
(4)若电解质溶液为浓硝酸,则Fe棒上发生的电极反应为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
CH3CH3COO﹣+H+ △H>0 ,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是_________。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol·L﹣1 d.加入少量冰醋酸
(2)等物质的量浓度的Na2CO3、NaClO、CH3COONa、NaHCO3的pH由大到小的顺序是____________。
(3)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
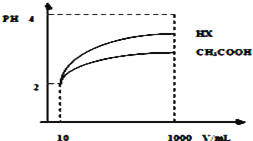
(4)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图所示.则HX的电离平衡常数____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)______________醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=_________________(填准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2。的反应方程式是MnO4-+NO2-+□→Mn2++NO3-+H2O。下列叙述中正确的是( )
A. 该反应中 NO2-被还原 B. 反应过程中溶液的pH 减小
C. 生成1 mol NaNO3需消耗 0.4mol KMnO4 D. □中的粒子是 OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com