
将12.4 g NaOH和NaHCO3组成的固体混合物置于密闭容器中,加热到250 ℃,经充分反应后排出气体,冷却后称量剩余固体质量为10.6 g。试求原混合物中NaOH的质量分数。
32%
根据题干提示信息,已知NaOH与NaHCO3的总质量,所以两者之间的反应有以下三种情况:
(1)恰好完全反应,
NaOH+NaHCO3══Na2CO3+H2O
固体减少的质量等于生成的水的质量
(2)NaHCO3过量,则发生以下两个反应
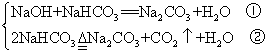
固体减少的质量等于第一个反应生成的水的质量与第二个反应生成的H2O、CO2质量之和。
(3)NaOH过量
NaOH+NaHCO3══Na2CO3+H2O
固体减少的质量等于生成的水的质量,但H2O的质量比第一种情况要小,首先分析第一种情况
①2NaHCO3![]() Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
生成的CO2被NaOH吸收:
②2NaOH+CO2![]() Na2CO3+H2O↑
Na2CO3+H2O↑
因此NaOH与CO2的反应有三种情况:
(1)NaOH不足,CO2有剩余;
(2)CO2不足,NaOH有剩余;
(3)NaOH和CO2恰好完全反应,二者都无剩余。先分析第(3)种情况。此时,混合物中NaHCO3与NaOH的物质的量之比为1∶1,相当于发生下列反应:
③![]()
![]() Na2CO3+H2O↑
Na2CO3+H2O↑
124 g 18 g
12.4 g m(H2O)
m(H2O)=![]() =1.8 g。
=1.8 g。
由于题干中12.4 g固体混合物完全反应后,也是失重1.8 g
所以原固体混合物中:
n(NaOH)∶n(NaHCO3)=1∶1。
则原混合物中NaOH的质量分数为:
w(NaOH)=![]() =
=![]() ×100%=32%。
×100%=32%。


科目:高中化学 来源:2012-2013学年江苏省扬州市高二下学期期末考试化学试卷(带解析) 题型:单选题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.0.5 L 1 mol/L NaHS溶液中,N(Na+)+N(HS—)=NA |
| B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6 NA |
| C.常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA |
| D.将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA |
查看答案和解析>>
科目:高中化学 来源:2010年山东省沂南一中高一上学期第一学段质量检测试题化学卷 题型:填空题
(12分)(1)将质量比为14︰15的N2和NO混合,则混合气体中N2和NO的物质的量之比为 ,氮原子和氧原子的个数比为 。
(2) 5molCO2在标准状况下所占的体积约为 ;所含氧原子的数目约为 。
(3)12.4 g Na2X中含有0.4 mol Na+,则Na2X的摩尔质量是 ,该物质的化学式为 。
(4)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O g。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省扬州市高二下学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5 L 1 mol/L NaHS溶液中,N(Na+)+N(HS—)=NA
B.12.4 g白磷(分子式为P4)中含有P—P共价键0.6 NA
C.常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA
D.将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为NA
查看答案和解析>>
科目:高中化学 来源:2010年山东省高一上学期第一学段质量检测试题化学卷 题型:填空题
(12分)(1)将质量比为14︰15的N2和NO混合,则混合气体中N2和NO的物质的量之比为 ,氮原子和氧原子的个数比为 。
(2) 5molCO2在标准状况下所占的体积约为 ;所含氧原子的数目约为 。
(3)12.4 g Na2X中含有0.4 mol Na+,则Na2X的摩尔质量是 ,该物质的化学式为 。
(4)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com