
【题目】I、从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)已知:Fe3O4(s) + CO(g)=3FeO(s) + CO2(g)ΔH1= +19.3 kJ·mol-1
3FeO(s) + H2O(g)=Fe3O4(s) + H2(g)ΔH2= -57.2 kJ·mol-1
C(s) + CO2(g)=2 CO(g)ΔH3= +172.4 kJ·mol-1
写出以铁氧化物为催化剂裂解水制氢气总反应的热化学方程式___________。
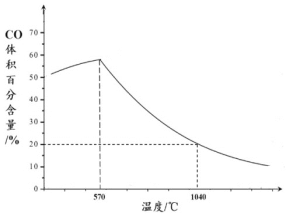
(2)下图表示其它条件一定时,Fe3O4(s)和CO(g)反应达平衡时CO(g)的体积百分含量随温度的变化关系。
①当温度低于570℃时,温度降低,CO的转化率__________(填“增大”、“减小”或“不变”),理由是_______________。
②当温度高于570℃时,随温度升高,反应Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
3FeO(s) + CO2(g)平衡常数的变化趋势是_________;(填“增大”、“减小”或“不变”);1040℃时,该反应的化学平衡常数的数值是____________。
II、汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
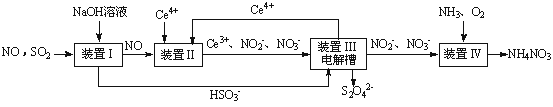
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成NO3-和NO2-物质的量之比为2:1时的离子方程式:________________________。
(2)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为_________。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1.5 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气___L(用含a代数式表示,结果保留整数,否则不给分)。
【答案】C(s) + H2O(g) = H2(g) + CO(g)ΔH= + 134.5 kJ·mol-1 增大 理由:当温度低于570℃时,温度降低,CO的体积百分含量降低,可逆反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)正向移动,故CO的转化率增大 增大 4 3NO+5H2O+7Ce4+=2NO3-+NO2-+10H++7Ce3+ 阳极 2H++2HSO3-+2e-=S2O42-+2H2O 365a
3Fe(s)+4CO2(g)正向移动,故CO的转化率增大 增大 4 3NO+5H2O+7Ce4+=2NO3-+NO2-+10H++7Ce3+ 阳极 2H++2HSO3-+2e-=S2O42-+2H2O 365a
【解析】
(1) ①Fe3O4(s) + CO(g)=3FeO(s) + CO2(g)ΔH1= +19.3 kJ·mol-1,
②3FeO(s) + H2O(g)=Fe3O4(s) + H2(g)ΔH2= -57.2 kJ·mol-1,
③C(s) + CO2(g)=2 CO(g)ΔH3= +172.4 kJ·mol-1,根据盖斯定律分析,由①+②+③可得热化学方程式为: C(s) + H2O(g) = H2(g) + CO(g)ΔH=+19.3-57.2+172.4= + 134.5 kJ·mol-1。 (2) ①从图分析,温度低于570℃时,可以看出温度降低,一氧化碳的百分含量减小,可逆反应Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)正向移动,故CO的转化率增大。②当温度高于570℃时,随温度升高,一氧化碳的百分含量减小,说明反应Fe3O4(s) + CO(g)
3Fe(s)+4CO2(g)正向移动,故CO的转化率增大。②当温度高于570℃时,随温度升高,一氧化碳的百分含量减小,说明反应Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)正向移动,则平衡常数增大。1040℃时,假设起始加入一氧化碳的物质的量为1mol/L,则
3FeO(s) + CO2(g)正向移动,则平衡常数增大。1040℃时,假设起始加入一氧化碳的物质的量为1mol/L,则
Fe3O4(s) + CO(g)![]() 3FeO(s) + CO2(g)
3FeO(s) + CO2(g)
0
x x
1-x x
有1-x/(1-x+x)=20%,则x=0.8mol/L,平衡常数为0.8/0.2=4。II、(1)假设一氧化氮的物质的量为3mol则根据题意生成2mol硝酸根离子和1mol亚硝酸根离子,则转移7mol电子,从图分析,Ce4+变为Ce3+,则需要Ce4+的物质的量为7mol,根据此数据书写离子方程式为:3NO+5H2O+7Ce4+=2NO3-+NO2-+10H++7Ce3+。 (2) 再生时生成的Ce4+的过程为化合价升高,即失去电子,所以该反应在阳极进行。同时另一极生成S2O42-是亚硫酸氢根离子得到电子,电极反应为: 2H++2HSO3-+2e-=S2O42-+2H2O。(3)从图分析,反应过程中亚硝酸根离子化合价升高,氧气化合价降低,根据电子守恒分析,氧气的体积为![]() =365aL。
=365aL。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(1)推断各符号所代表的物质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)分别写出反应②、⑤的化学方程式:
②______________________________________,
⑤__________________________________________。
(3)写出反应③的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元醇的化学式为C6H14O,已知其分子中有二个—CH3、三个—CH2—、一个![]() ,此一元醇可能的结构有
,此一元醇可能的结构有
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应![]() 已达到化学平衡状态的是( )
已达到化学平衡状态的是( )
①混合气体的压强②混合气体的密度③![]() 的物质的量的浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥
的物质的量的浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥![]() 与
与![]() 的比值⑦混合气体总质量.
的比值⑦混合气体总质量.
A. ②③⑤⑦B. ③④⑤⑥C. ①③④⑤D. ①②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)和H2O(g)以1 : 2体积比分别通入到体积为2 L的恒容密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

下列说法不正确的是
A. 从实验数据分析,该反应的正反应是吸热反应
B. 实验A中,在0~10min内,以v(H2)表示的反应速率大于0.013mol(L·min)-1
C. 从生产效益分析,C组实验的条件最佳
D. 比较实验B、C,说明C实验使用了更高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出具有下列分子式但仅有一个核磁共振信号的化合物的结构简式:
(1)C5H12_________________________;
(2)C3H6_______________________;
(3)C2H6O________________________;
(4)C3H4_______________________;
(5)C2H4Br2_______________________;
(6)C4H6_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的是( )


A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。

(1)仪器P的名称是______。
(2)写出装置A中烧瓶内发生反应的离子方程式:_________。
(3)B装置中所盛试剂是_____,G瓶的作用是_______。
(4)F为ClO2收集装置,应选用的装置是____(填序号),其中与E装置导管相连的导管口是_____(填接口字母)。

(5)若用100 mL 2 mol·L-1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是_____(填序号)。
A.>0.1mol B.0.1 mol C.<0.1 mol D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化工生产原理错误的是( )
①可以电解熔融的氯化钠来制取金属钠②可以将钠加入氯化镁饱和溶液中制取镁③用电解法冶炼铝时,原料是氯化铝④高炉炼铁的反应是放热的,故无需加热
A.②③④B.①③C.①②③D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com